Выбор белка
Первым делом я решил проверить, есть ли ЯМР-структура для белка 1XTM, который я изучаю в данных практикумах. Таковая нашлась - 1U3N.
Однако оказалось, что SOD-подобный белок из B. subtilis является неструктурированным в растворе, особенно без ионов цинка, но имеет твёрдую структуру в кристалле. Пришлось искать новый белок.
Примечание
Утверждается, что Zn/Cu супероксид дисмутаз (SOD) почти нет в археях, однако они есть у бактерий. Но у одних бактерий они не способны связывать ионы, а у других - способны и даже могут выполнять свои функции. Таким образом, можно проследить эволюционный градиент от неструктурированных белков к настоящим бактериальным SOD. Мне кажется, это может быть интересной темой по эволюции структур белков для журнального клуба. Возможно, уже есть готовые статьи по этому, т.к. это было известно ещё в 2005 году.
Продолжение
В итоге, из предложенной таблицы был выбран PDZ домен белка ERBIN (LAP2). Таблица 1 содержит информацию о расшифровке его структуры.
| Код PDB | Разрешение (Å) | Код PDB | Число моделей | ||
|---|---|---|---|---|---|
| РСА | 2H3L | 1.0 | ЯМР | 1N7T | 20 |
Расшифрованные структуры оказались на удивление похожи, за исключением концов белка (см. рис 1), которые в кристалле укладываются в β-тяжи, а в растворе флуктуируют.
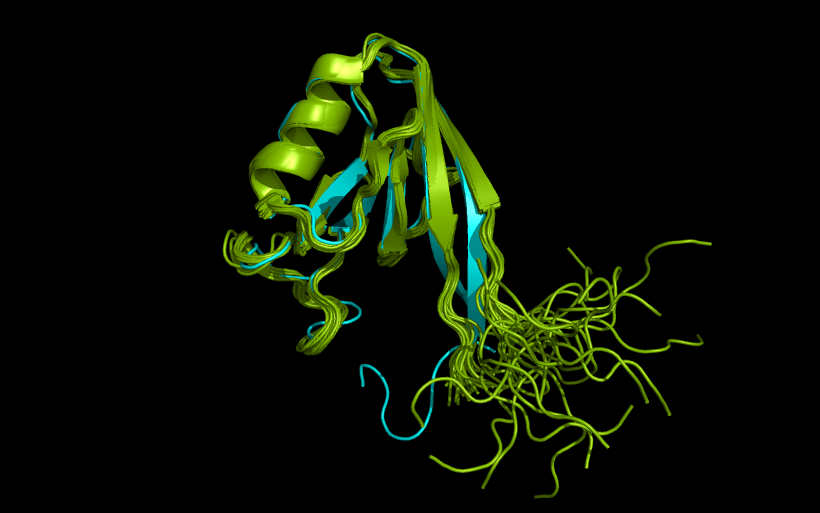
Рисунок 1. Совмещение структуры 2H3L (голубой) и модели 1 структуры 1N7T (зелёный), выполененное посредством PyMol.
Сравнение водородных связей
Для сравнения между структурами, полученными методами РСА и ЯМР, было выбрано 3 водородных связи (см. табл. 2).
| Номер | Донор | Акцептор | Вторичная структура | Расположение |
|---|---|---|---|---|
| 1 | A:Leu1395(86).N | A:Ala1391(82).O | Спираль, остов | Ядро |
| 2 | A:Arg1408(99).NH2 | A:Asp1373(64).OD2 | Боковые цепи петли и β-тяжа | Ядро |
| 3 | A:Arg1348(39).NH2 | A:Asp1351(42).OD2 | Петли, боковые цепи | Поверхность |
В данной работе предполагается, что для образования водородной связи между полярными атомами должно быть не больше 3.5 Å. Для подсчёта расстояний между атомами в моделях ЯМР структуры использовался скрипт для среды PyMol. В таблице 3 представлена обобщённая информация о длинах рассматриваемых водородных связей.
| Номер | Расстояние между атомами (Å) | Встречаемость в ЯМР | |||
|---|---|---|---|---|---|
| РСА | ЯМР | ||||
| Минимальная | Медиана | Максимальная | |||
| 1 | 3.0 | 3.03 | 3.23 | 3.30 | 20/20 (100%) |
| 2 | 2.8 | 3.99 | 6.35 | 9.36 | 0/20 (0%) |
| 3 | 3.2 | 3.33 | 7.97 | 9.43 | 1/20 (5%) |
Водородная связь №1 расположена в α-спирали с внутренней стороны белка. Эта связь, как и должно быть, оказалась очень стабильной, т.к. наблюдается во всех 20 моделях ЯМР (см. рис 2).
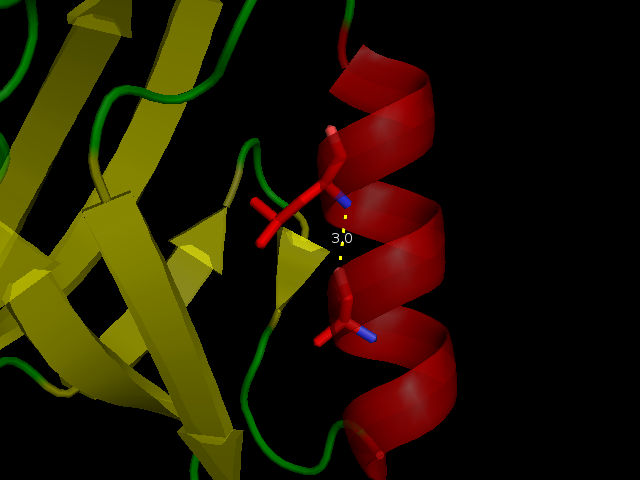
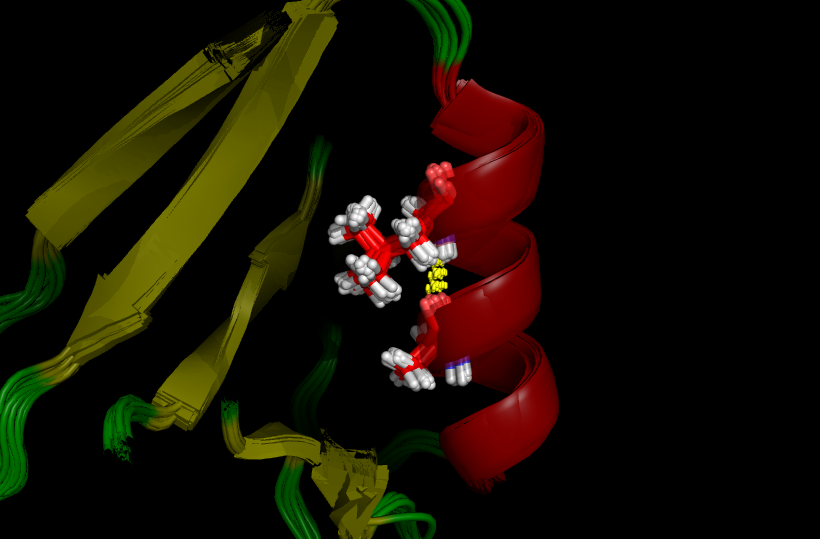
Рисунок 2. Водородная связь №1 в структуре 2H3L (слева) и в 1N7T (справа). Боковые цепи взаимодействующих остатков почти неподвижны.
Водородная связь №2 лежит внутри белка под самой поверхностью (видно на рис. 3 слева) и недоступна воде. Её образуют боковые группы аргинина (лежит в β-тяже) и аспартата (лежит в петле). Однако аргинин 1408 (99) расположен близко к С-концу белка, из-за чего включающий его β-тяж расплетается в растворе и приобретает подвижность. Из-за этого в ЯМР (см. рис. 3 справа) структуре этой водородной связи нет (вернее есть одна, очень слабая, длиной 4Å). Причём в ЯМР структуре этой связи нет ни в одной из комбинаций атомов из (NH1, NH2) и (OD1, OD2).
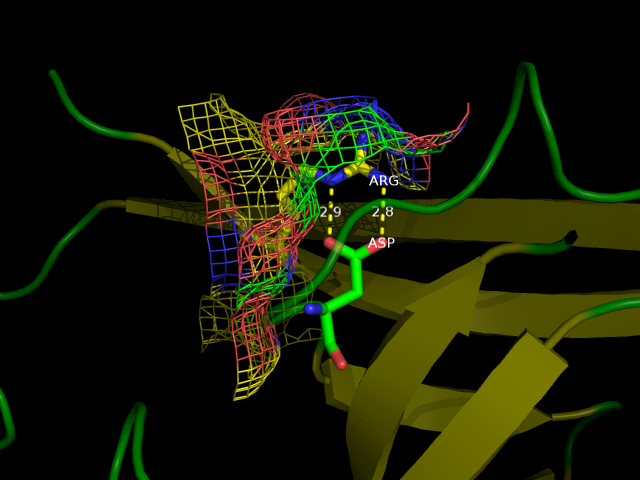
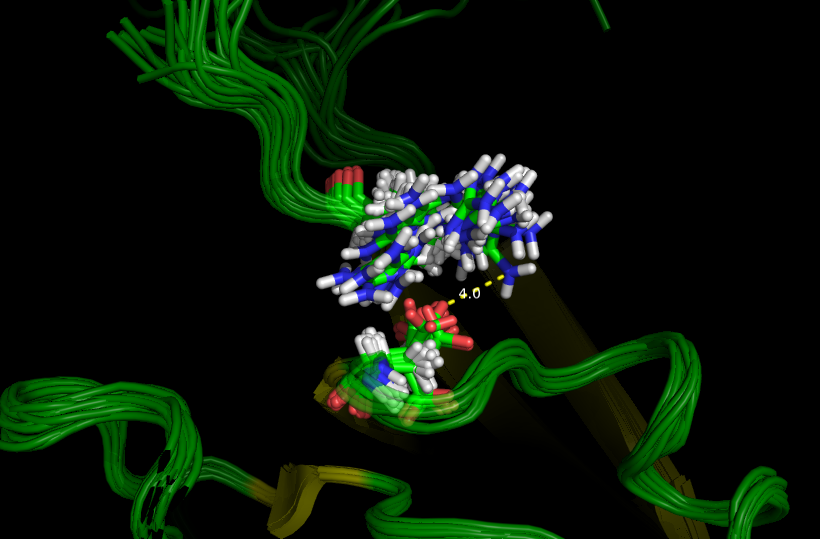
Рисунок 3. Водородная связь №2 в структуре 2H3L (слева) и в 1N7T (справа). Боковые цепи взаимодействующих остатков подвижны.
Водородная связь №3 лежит на самой поверхности белка в петлях между остатками аргинина и аспартата, которые очень подвижны в растворе (см. рис. 4). Из-за этого данная связь встречается в ЯМР-структуре всего 1 раз, причём не встречается в других комбинациях из (NH1, NH2) и (OD1, OD2)
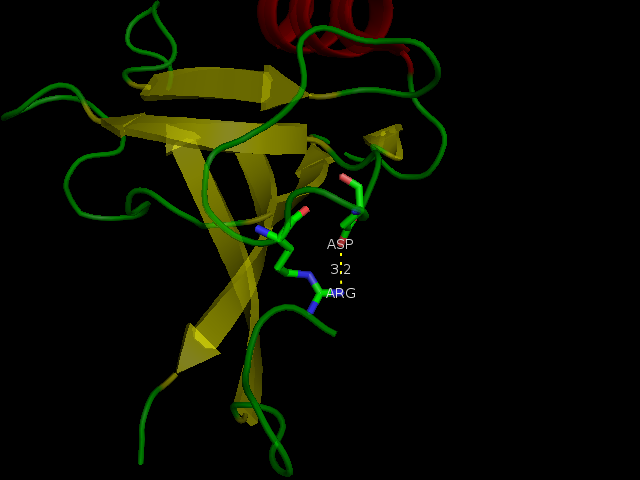
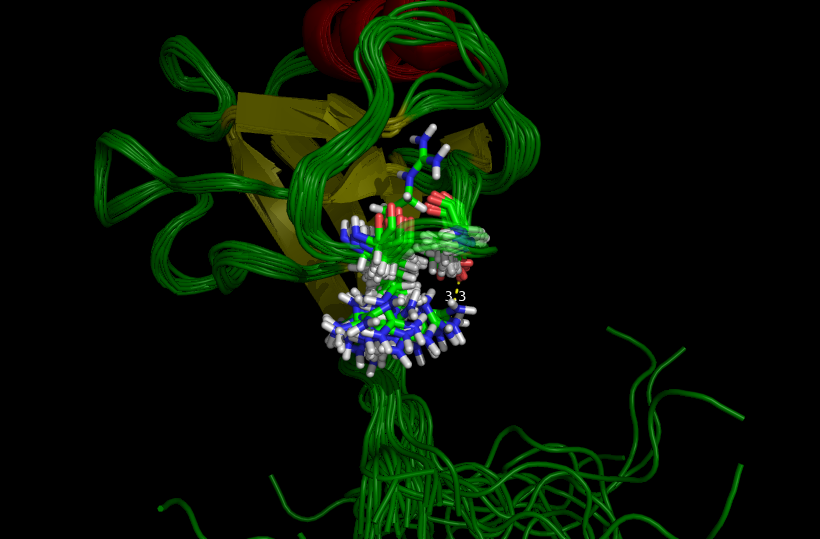
Рисунок 4. Водородная связь №3 в структуре 2H3L (слева) и в 1N7T (справа). Боковые цепи взаимодействующих остатков подвижны.
Выводы
Не смотря на сильную схожесть остова структур PDZ домена белка ERBIN в кристалле и растворе, боковые группы аминокислотных остатков имеют большую подвижность, из-за чего водородные связи, наблюдаемые в кристалле, теряются в растворе.
Дополнительно
Сравнение выводов
Изученный белок взят из статьи Sikic et al., 2010, а значит полученные выводы можно сравнить с выводами аторов статьи.
- Авторы утверждают, что ЯМР и РСА-структуры в среднем разнятся. Видимо, представленный белок не попал в правило, к тому же здесь не проведено никаких количественных сравнений, только "на глаз".
- По мнению авторов, β-листы в среднем более консервативны, чем α-спирали и β-повороты. В данном же случае, наоборот, α-спирали устойчивее, нежели β-листы (см. рис. 5)
- Авторы говорят о том, что не смотря на хорошее совпадение остова белка, боковые цепи аминокислотных остатков часто не совпадают или вообще направлены в другую сторону, особенно в петлях. Действительно, так и есть, это хорошо видно на рис. 4 - один из аргининов смотрит вверх, в то время как остальные направлены вниз, а ход цепи совпадает.
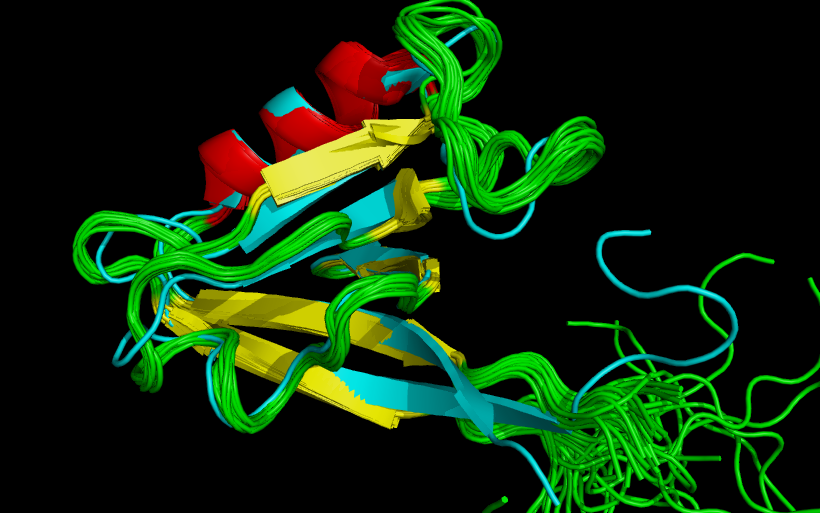
Рисунок 5. Наложение β-листов и α-спиралей стуктур 2H3L (голубой) и 1N7T (иные цвета). Спирали точь-в-точь совпали, а вот второй сверху β-тяж - нет, не говоря уже о концевых β-тяжях.