Лиганды в структуре 3CBW
С исследуемым белком взаимодействуют три лиганда. Все три - молекулы цитрата (лимонной кислоты) [CYT] (Рис. 1):
В Табл. 1 приведены размеры белка и лигандов:
| Объект | Параметр | Длина (Å; нм; м) |
| Белок | Длина | 82.44 Å; 8.244 нм; 8.244*10-9 м |
| Ширина | 64.6 Å; 6.46 нм; 6.46*10-9 м | |
| Высота | 45.87 Å; 4.587 нм; 4.587*10-9 м | |
| Цитрат [CYT] |
Длина | 7.15 Å; 0.715 нм; 0.715*10-9 м |
| Ширина | 3.48 Å; 0.348 нм; 0.348*10-9 м | |
| Высота | 2.8 Å; 0.28 нм; 0.28*10-9 м |
Табл. 1 Размеры белка и лигандов
Сайты связывания молекул цитрата располагаются на внешней поверхности исследуемого белка (Рис. 1):
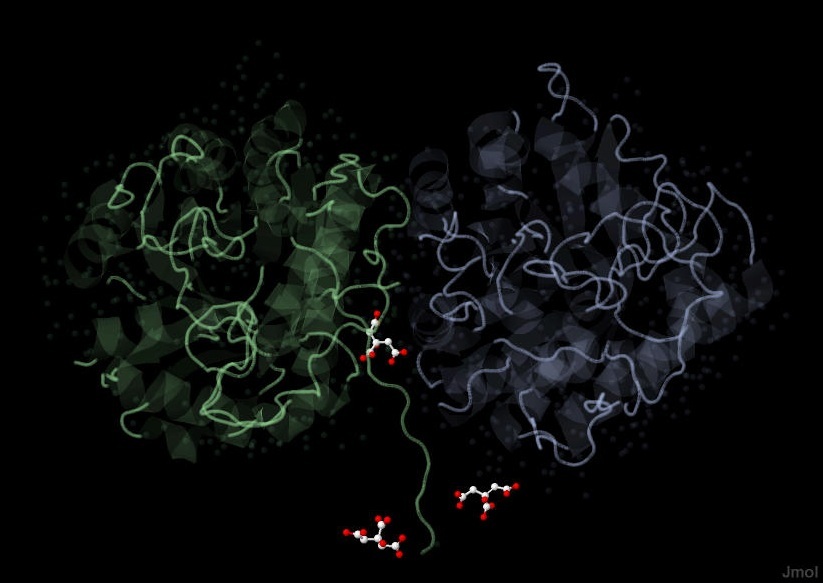
Рис. 1 Лиганды исследумого белка - три молекулы цитрата.
Основная функция исследууемого белка - это расщепление гликозидных связей в растительном полимере - маннане, т.е. получение её мономеров - молекул маннозы. Я предположил, что все три молекулы цитрата, являющиеся слабыми органическиими кислотами, входят в состав активного сайта фермента и выступают в качестве кофакторов (Рис. 2):
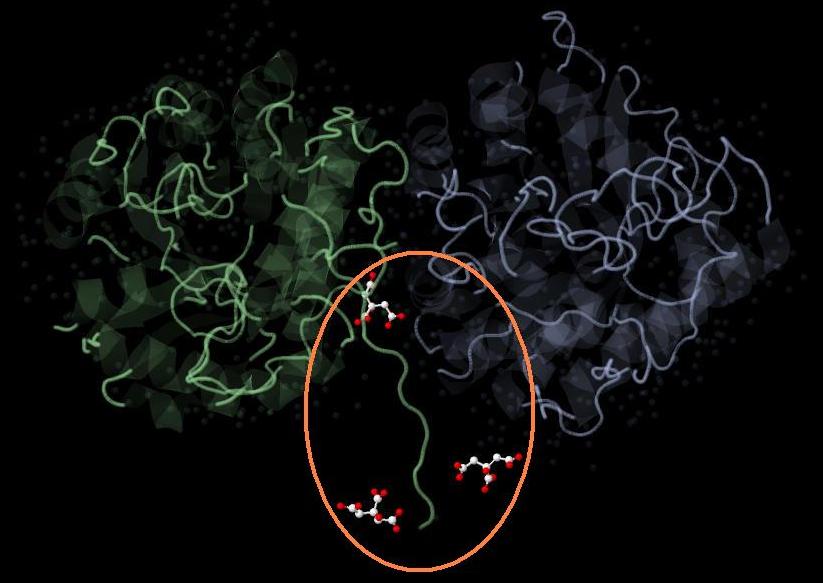
Рис. 2 Гипотетический активный сайт фермента.
Анализ области контакта белка из структуры 3CBW и лиганда CYT 1
Первая молекула цитрата [CYT 1], в отличие от остальных двух, располагается ближе к центру белка, а также взаимодействует с бОльшим количеством аминокислотных остатков исследуемого белка (Рис. 3):
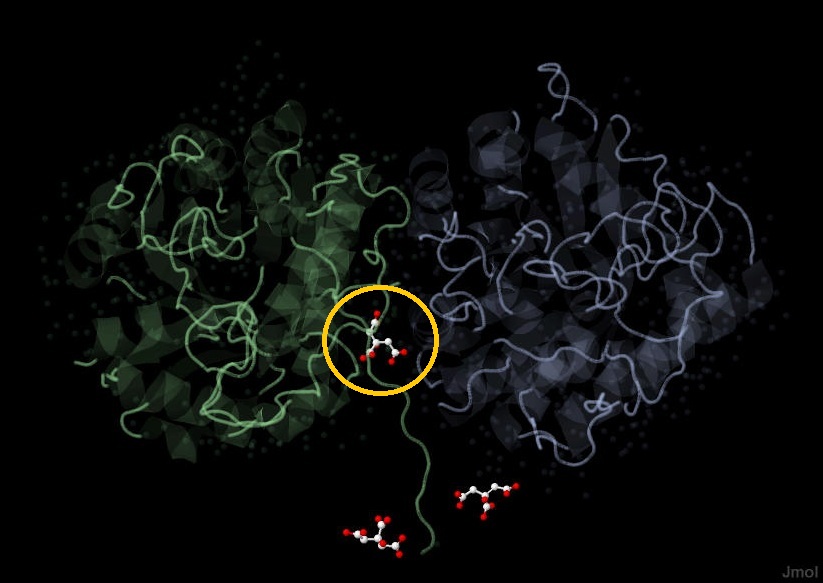
Рис. 3 Область контакта лиганда CYT 1 с исследуемым белком.
Что касается вторичных структур, то с лигандом контактируют две альфа-спирали (Рис. 4):
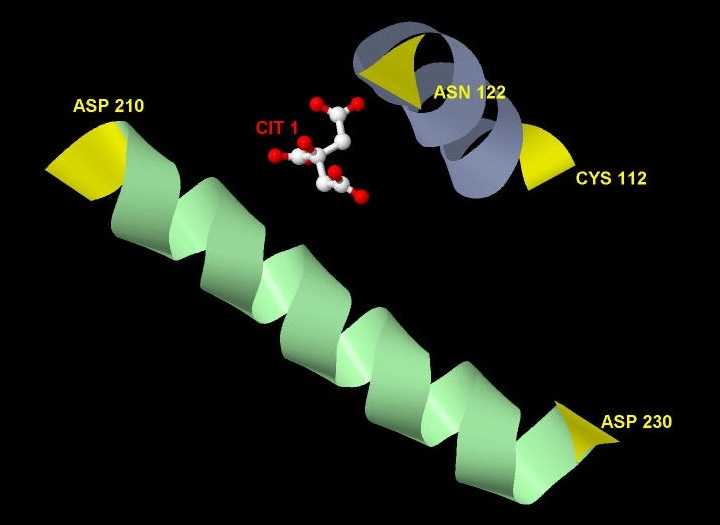
Рис. 4 Сайт связывания - вторичные структуры, контактирующие с лигандом. Концевые аминокислотные остатки отмечены желтым цветам.
Три положительно-заряженные аминокислотные остатки Лизина с лигандом образуют солевые мостики. Также амнокислотные остатки Серина, Аспарагина и Глутамина образуют с лигандом водородные связи. (Рис. 5):
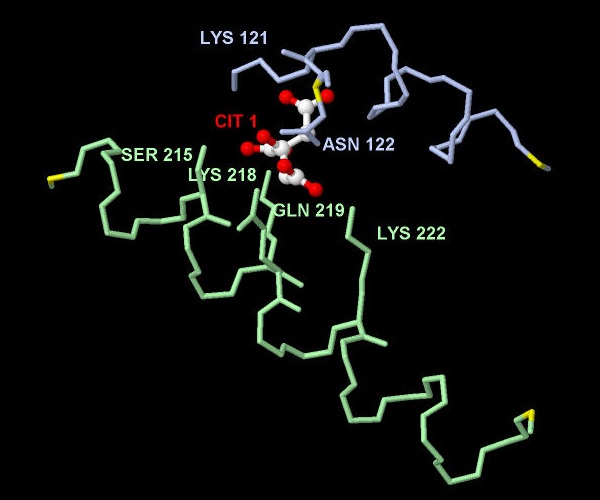
Рис. 5 Сайт связывания - аминокислоты, контактирующие с лигандом. У всех аминокислотных остатков, взаимодействующих с молекулой лимонной кислоты указано трехбуквенное название и номер остатка.
Кроме того, с цитратом три молекулы воды образуют водородные связи (Рис. 6):
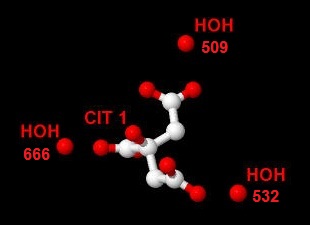
Рис. 6 Молекулы воды, образующие водородные связи с лигандом.
Сайт связывания исследуемого лиганда детально проиллюстрирован на схеме (Рис. 7):
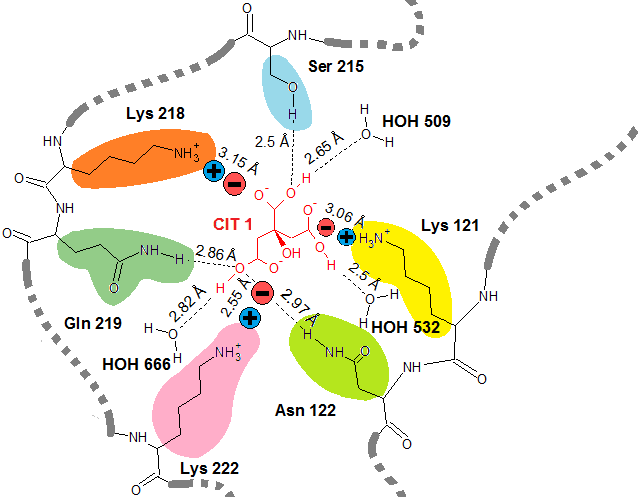
Рис. 7 Схема сайта связывания лиганда CYT 1. Здесь показаны все типы взаимодействий, складывающиеся между лигандом и её окружением. Длины взаимодействий указаны в ангстремах (Å). Пунктиром обозначена водородная связь. Знаком "плюс" и "минус" - солевой мостик.
Изображения 1-6 можно получить с помощью скрипта JMol (Скачать).
Проект генно-инженерного эксперимента с белком из структуры 3CBW
В составе сайта связывания лиганда есть несколько положительно заряженных аминокислотных остатков, а именно: остатков Лизина. Положительно заряженные остатки Лизина необходимы в сайте связывания для удержания лиганда, которая является отрицательно заряженной органической кислотой.
Очевидно, что замена хотя бы одного остатка Лизина приведет к потере белком способности связывать лиганд. Подобный исход будет однозначен, если замена будет произведена на любую, кроме положительно заряженных аминокислот. Например, если произвести замену на Фенилаланин, то гидрофобный радикал этого амонокислотного остатка вообще будет обращен в центр молекулы белка, стараясь "спрятаться" от водного окружения (Рис. 8):
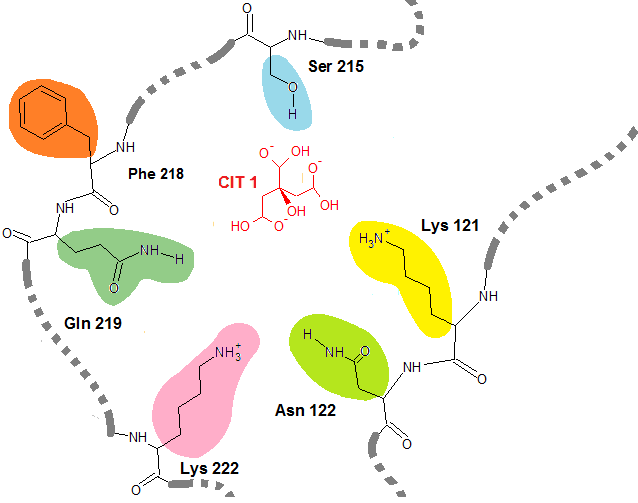
Рис. 8 Потеря белком способности связывать лиганд
Но если Лизин заменить на положительно заряженный Аргинин, то скорее всего белок сохранит свою способность связывать молекулу цитрата (Рис. 9):
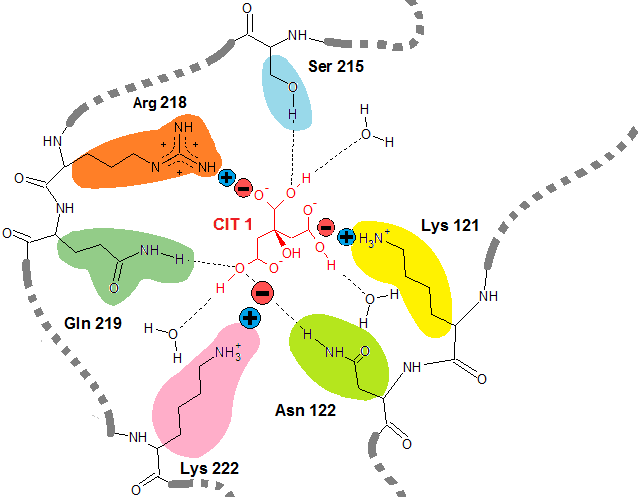
Рис. 9 Сохранение белком способности связывать лиганд.