I
В качестве фермента для анализа был взят белок SpnF из бактерии Saccharopolyspora spinosa. Этот фермент интересен в первую очередь тем, что катализирует реакцию [4 + 2] циклоприсоединения (реакция Дильса-Альдера) в процессе образования спинозина А. Спинозины — это целый ряд соединений, в основе которых лежит тетрациклическая структура, дополненная углеводными заместителями. Такие структуры называются макролидами. По своей биохимической природе спинозин представляет собой вторичный метаболит, а большинство вторичных метаболитов проявляют антибактериальную активность (то есть являются антибиотиками). Однако выяснилось, что спинозин, производимый клетками Saccharopolyspora spinosa, в отличие от других макролидов не обладает выраженной антибактериальной активностью, но проявляет инсектицидную активность, что нехарактерно для макролидных антибиотиков.
Фундаментальный интрес этот белок представляет в первую очередь потому, что раньше реакция Дильса-Альдера считалась исключительно синтетическим методом органической химии; не было достоверно известно про ферменты, катализирующие данный процесс. Схема реакции представлена на рисунке ниже.
Более подробно про историю исследования этого белка можно прочитать в научно-популярной статье на сайте elementy.ru. В марте 2015 года в журнале Nature Chemical Biology была опубликована расшифрованная структура этого белка, которая теперь хранится в базе данных PDB c ID 4PNE. Этот белок также удобен для целей практикума, потому что он выполняет ряд требований, поставленных в задаче.
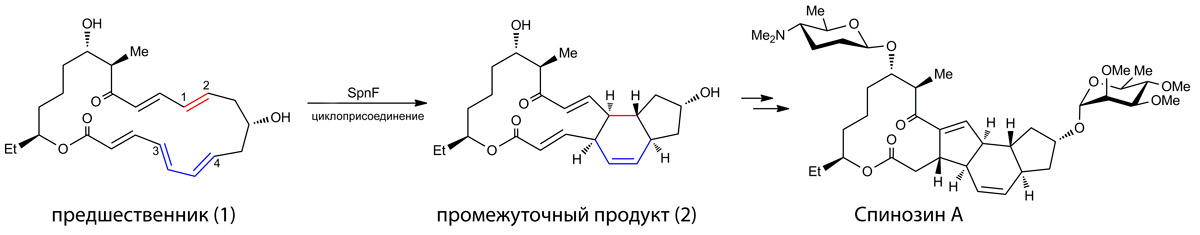
На рисунке ниже представлено изображение структуры 4pne с визуализацией электронной плотности вокруг остова полипептидной цепи с различными значениями уровня подрезки (σ) — 1.5, 2.5 и 3.5. Видно, что на уровнях подрезки 2.5 и 3.5 в структуре уже образуются «бреши».
II
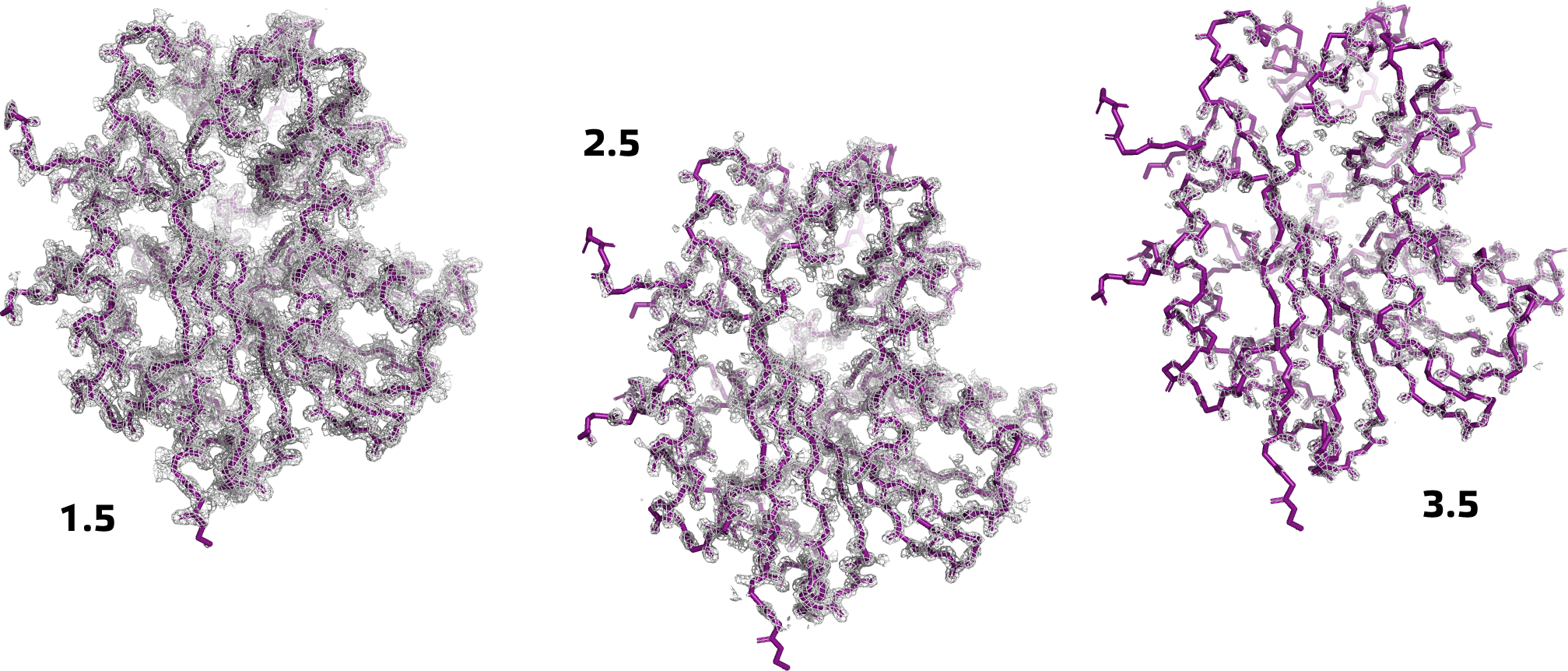
Для более детального рассмотрения дальше были выбраны три идущие подряд остатка: Trp194, Pro195 и Thr196. На рисунке ниже представлена иллюстрация поведения электронной плотности вокруг этих аминокислотных остатков при разных значениях подрезки (σ = 1.5, 2.5 и 3.5).
Из рисунка видно, что электронная плотность сконцентрирована вокруг ароматической системы триптофана (что, вообще говоря, неудивительно), а также на атомах кислорода и азота, входящих в состав пептидной связи (вероятно, из-за возникающего там резонанса). Из этого можно сделать вывод о том, что расположение радикалов в пространстве может быть расшифровано хуже, чем собственно вторичная структура белка (ход остова цепи).