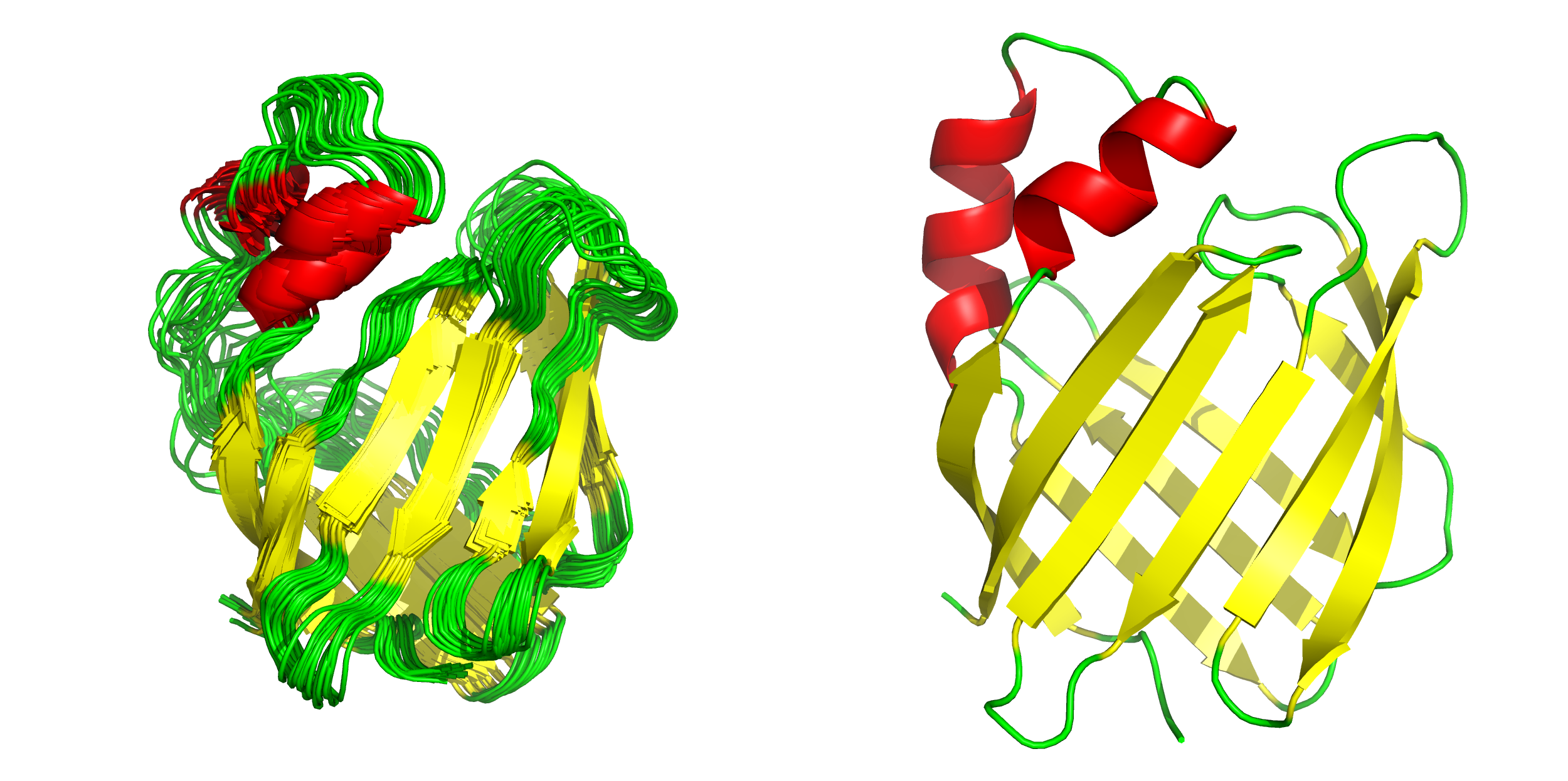
Для того, чтобы сравнить качество определения структуры, а также удобство работы с результатами идентификации структуры белка разными методами, был взят белок CRABP2, или белок, связывающий ретиноевую кислоту. Для этого белка структура имеется как полученная методом X-Ray (1XCA), так и ЯМР (1BLR). Для последней структуры на PDB выложены 22 модели. На рисунке снизу показаны модели исследуемого белка. Слева — наложенные модели, полученные при обработке результатов ЯМР; справа — результат РСА.
Видно, что структуры в целом похожи. Но насколько? Что мы можем увидеть в одной структуре, чего не можем в другой? Для этого было решено рассмотреть в этих структурах водородные связи.
Водородную связь считаем актуальной, когда расстояние между донорм и акцептором протона не превышает 3.5 Å. Для детального анализа были выбраны три водородные связи: одна (I) в бета-листе, другая (II) образована боковыми цепями в ядре белка и третья (III) находится у поверхности глобулы. Их изображение на структуре, полученной методом РСА, показано ниже.
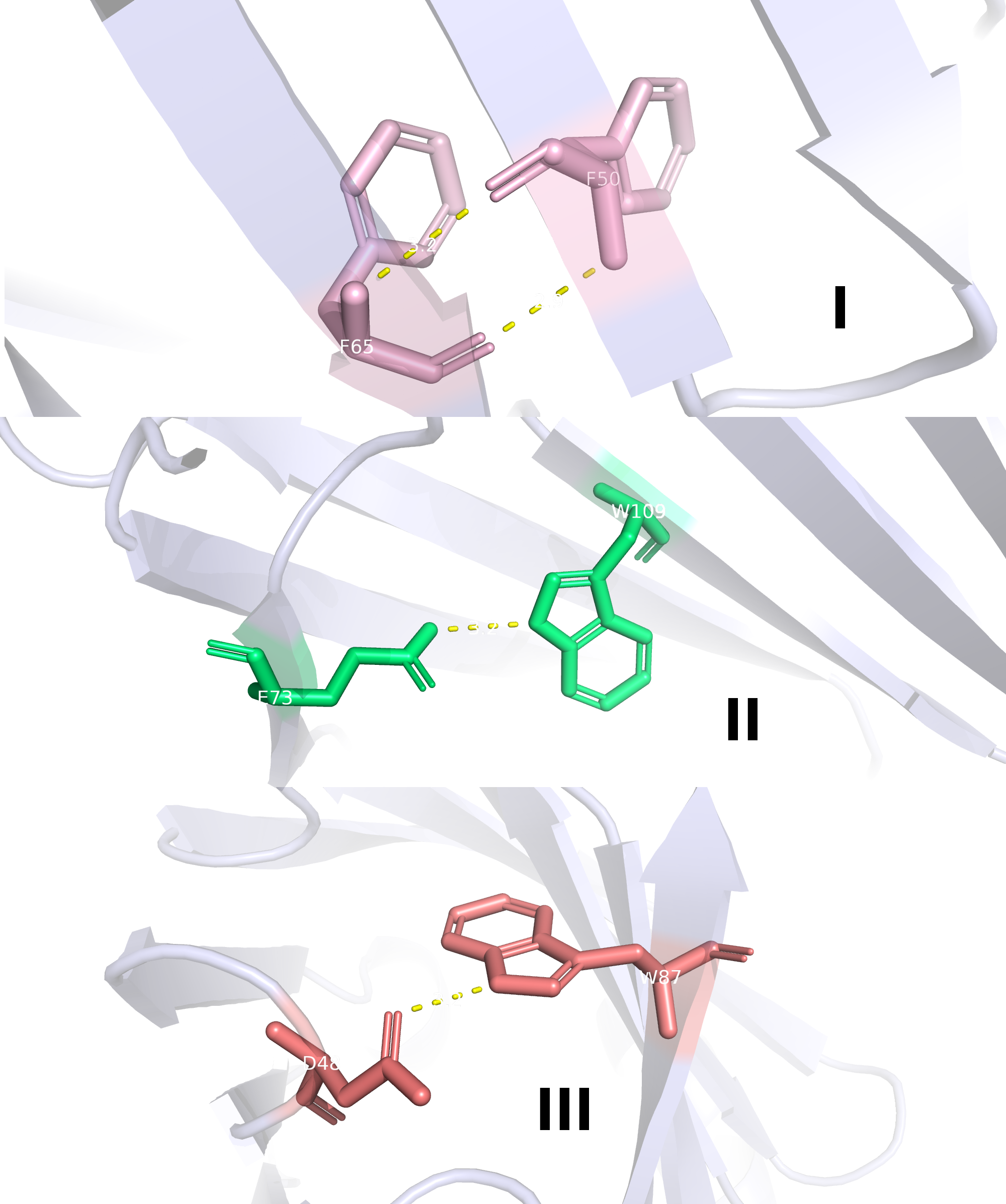
Анализ присутствия таких же водородных связей в структурах, полученных методом ЯМР, дал следующие результаты:
Остатки
Описание
Длина связи (Å), РСА
Число моделей со связью (ЯМР)
Min длина связи, Å (ЯМР)
Max длина связи, Å (ЯМР)
Median длина связи, Å (ЯМР)
65Phe(O) + 50Phe(N)
Остов бета-листа
2.9
22 (100%)
2.9
3.1
3.02
48Asp(OD1) + 87Trp(NE1)
Боковые цепи в ядре белка
3.2
0 (0%)
-
-
-
109Trp(NE1) + 73Glu(OE2)
Остатки, близкие к поверхности
3.2
0 (0%)
-
-
-
В итоге во всех ЯМР присутствует водородная связь между аминокислотами бета-складчатого листа. Другие же проявления двойной связи ЯМРом зафиксированы не были, что говорит как о нечувствительности метода, так и о том, что фолдинг этих участков менее консервативен.