Атлас аминокислот: аланин[1]
Введение
| Тривиальное название | Аланин / Alanine |
| Трехбуквенный код | Ala |
| Однобуквенный код | A |
| Название по IUPAC | 2-аминопропановая кислота |
| Структурная формула | 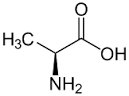 |
| Брутто-формула | C3H7NO2 |
| Молярная масса | 89,09 г/моль |
| PubChem CID | 7311724 |
| Заменимость | заменимая |
| Химические характеристики | протеиногенная, неполярная, алифатическая |
| Встречаемость в белках | 7,8% |
| Кодируется | CGA, CGT, CGC, CGG |
| Изображение в шариково-стержневой модели с подписанными именами тяжелых атомов | 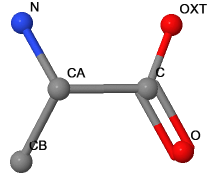 |
| Вращение: | |
| Тяжелые атомы: | |
| Водород: | |
Структура
Аланин открыт Вейлем в 1888 г в фиброине шелка.
Альфа-углеродный атом аланина связан с метильной группой (-CH3), что делает аланин одной из самых
простых альфа-аминокислот в отношении молекулярной структуры. Метильная группа аланина не является
реактивной и, таким образом, почти никогда непосредственно не участвует в функционировании белка.
Однако боковые цепи аланина, а также валина, лейцина и изолейцина в белках в результате гидрофобных
взаимодействий стремятся объединяться в кластеры, что стабилизирует структуру белка.
Аланин имеет радикальную группу небольшого размера, поэтому не мешает полипептидной цепи укладываться в
бета-слои. Наиболее высокое содержание аланина (29,7%) наблюдается в таком β-кератине, как фиброин шелка.
Остатки Gly и Ala чередуются в фиброине на протяжении довольно длинных участков полипептидной цепи[2].
Впервые аланин был синтезирован Штреккером в 1850 г. действием на ацетальдегид аммиаком и синильной кислотой
с последующим гидролизом образовавшегося α-аминонитрила:
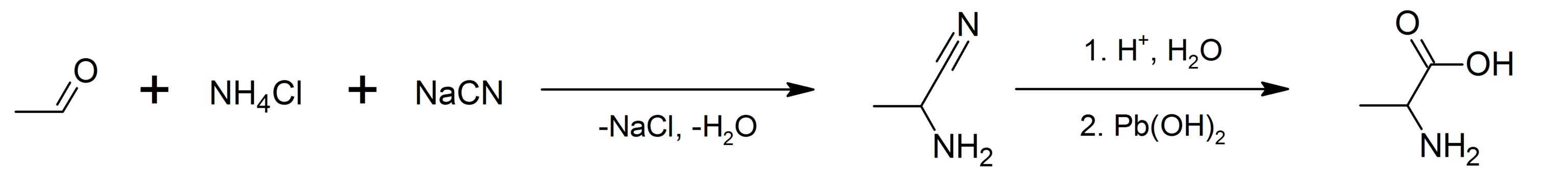 |
В лабораторных условиях аланин синтезируют взаимодействием с аммиаком α-хлор или α-бромпропионовой кислоты[4]:
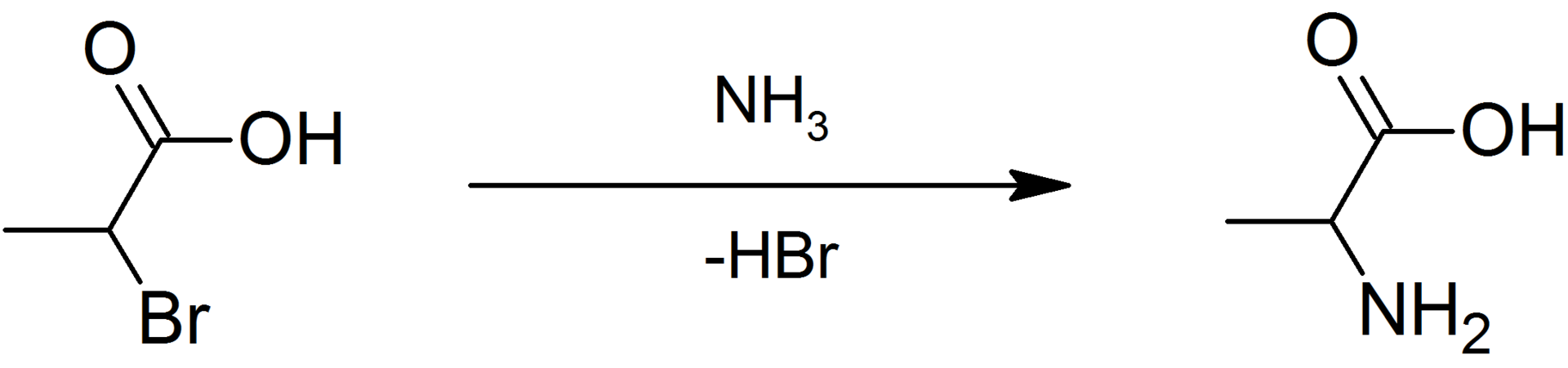 |
Аланин в продуктах питания
Аланин может синтезироваться в организме человека, и нет необходимости принимать его с пищей. Аланин
встречается в широком разнообразии продуктов, а особенно - в мясе. Источники аланина:
1)Животные источники: мясо, морепродукты, казеинат, молочные продукты, яйца, рыба, желатин, лактальбумин;
2)Растительные источники: семена подсолнечника, овес, зародыши пшеницы, авокадо, бобовые, орехи, семена,
соя, сыворотка, пивные дрожжи, коричневый рис, отруби, кукуруза, цельные зерна[3].
Физиологическая роль аланина
Является основным компонентом соединительной ткани.
В организме синтезируется из разветвленных аминокислот (лейцин, изолейцин, валин), пировиноградной кислоты.
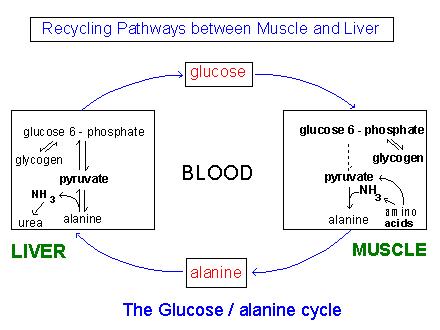 |
Во время перерывов между приемами пищи, особенно продолжительных, некоторое количество белков мышц
расщепляется до аминокислот. Эти аминокислоты с помощью реакции трансаминирования отдают свои аминогруппы
продукту гликолиза пирувату, образуя аланин, который транспортируется в печень и там дезаминируется.
Гепатоциты в процессе глюконеогенеза превращают получившийся пируват в глюкозу крови, а аммиак в мочевину,
которая выводится из организма. Дефицит аминокислот в мышцах восстанавливается после нескольких приемов пищи.
Нарушения в этом цикле повышают риск развития диабета II типа.
Таким образом, аланин участвует в глюкозо-аланиновом цикле, который позволяет сглаживать колебания уровня
глюкозы крови между приемами пищи[4].
Кроме того, международное исследование под руководством Имперского колледжа в Лондоне обнаружило корреляцию между высоким
уровнем аланина и повышенным кровяным давлением, потребляемой энергией, уровнем холестерина и индексом массы тела.
Основные функции:
• выработка мышечной энергии;
• регулировка уровня энергетического обмена;
• стимуляция иммунитета; регулирование уровня сахара;
• выработка лимфоцитов; поддержание тонуса мышц;
• поддержка половой функции;
• работа надпочечников;
• детоксикация аммиака;
• метаболизм сахаров и органических кислот.
Системы и органы:
- мышечная ткань;
- головной мозг;
- соединительная ткань.
Последствия дефицита:
- гипогликемия;
- при больших физических нагрузках — распад мышечной ткани.
Последствия переизбытка:
- инфицирование вирусом Эпштейна-Барра;
- синдром хронической усталости.
У животных избыток аланина индуцирует мутагенез.
 |
Аланин применяется с целью укрепления иммунной системы, снижения риска образования камней в почках. Как вспомогательное
средство при лечении гипогликемии, для смягчения приступов эпилепсии. Является важным источником энергии для головного
мозга и центральной нервной системы. Также используется для устранения вегетативных симптомов по типу приливов,
обусловленных естественной или ятрогенной предменопаузой, менопаузой и постменопаузой, при невозможности назначения
заместительной гормональной терапии; перед назначением заместительной гормональной терапии; в комбинации с
заместительной гормональной терапией при ее недостаточной эффективности.
Аланин входит в состав множества медицинских препаратов[3],
а также в состав БАД и многих энергетических и спортивных формул.
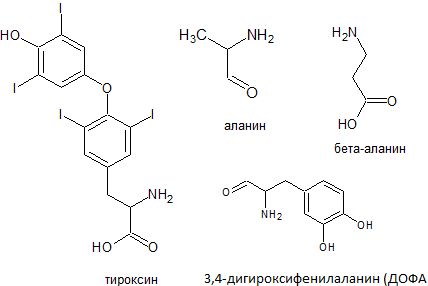
Аланину соответствует свыше 30 производных, различающихся заместителями атома водорода метильной группы (см. рис. 4).
Например, гормон щитовидной железы тироксин с йод замещенной ароматической боковой цепью; бета-аланин
(основная составляющая кофермента А), ДОФА (3,4-дигироксифенилаланин), необходимый для синтеза меланина[2],
мышечные белки карнозин и анзерин, коэнзим А, пантотеновая кислота (витамин B5), фермент аланин-аминотрансфераза (АЛТ).
Физико-химические свойства
 |
| Вращение: | |
| Тяжелые атомы: | |
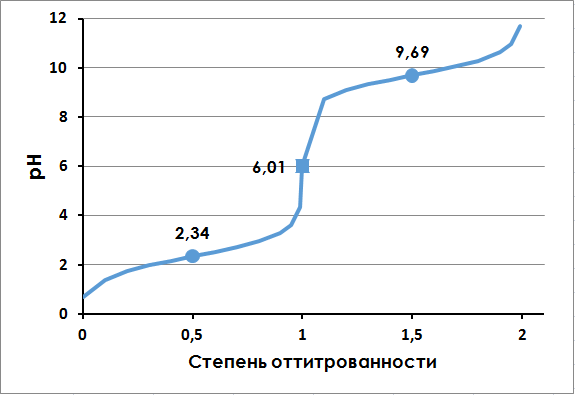
На рис.5 представлена кривая титрования аланина (файл Excel с вычислениями). Из кривой титрования следует, что карбоксильная
группа имеет рКa1=2,34, а протонированная аминогруппа — рКa2= 9,69. При рН = 6,01
аланин существует в виде биполярного иона (цвиттер-иона), когда суммарный электрический заряд частицы равен 0. При
этом значении рН молекула аланина электронейтральна. Такое значение рН называют изоэлектрической точкой
и обозначают рI. Изоэлектрическая точка рассчитывается как среднее арифметическое двух значений рКa.
Для аланина: рI= ½ *c(рКa1 + рКa2) = ½ * (2,34 + 9,69) = 6,01.
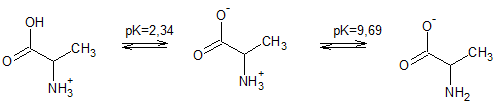 |
На рис.6 показаны разные формы существования молекулы аланина. Это стоит понимать так: при определенном рКa появляется соответствующая форма, и затем процент ее содержания постепенно увеличивается.
Белок-белковые контакты
| Вращение: | Тяжелые атомы: | ||
| Измерения: | |||
| Скрипт | |||
Вы увидите (по порядку):
1) шаро-стержневая модель аланина (до нажатия каких-либо кнопок)
2) общий вид пептидной связи на примере аланина и аргинина (PDB ID:3W4S, [ALA]113:A и [ARG]114:A)(после нажатия "Запустить")
3) общий вид остовной водородной связи на примере аланина и фенилаланина (PDB ID:3W4S, [ALA]124:A и [PHE]128:A) (после нажатия "Продолжить")
4) гидрофобные взаимодействия (использовался сервис
CluD) (PDB ID:3D4U, [ALA]178:A, [VAL]179:A, [PHE]147:A, [ILE]38:A, [LEU]47:A, [TRP]63:A)
Аланин - гидрофобная аминокислота, боковой радикал которой часто входит в состав гидрофобных ядер (обозначены черным).
Аланин также относится к алифатическим аминокислотам, поэтому водородные связи с участием бокового радикала и солевые мостики
для аланина не характерны.
Белок–белковые взаимодействия лежат в основе многих физиологических процессов, связанных с ферментативной активностью и ее регуляцией,
электронным транспортом и др. Процесс образования комплекса двух белковых молекул в растворе можно условно разделить на несколько стадий:
1) свободная диффузия молекул в растворе на большом расстоянии от других макромолекул,
2) сближение макромолекул и их взаимная ориентация за счет дальнодействующих электростатических взаимодействий с образованием
предварительного (диффузионно-столкновительного) комплекса,
3) трансформация предварительного комплекса в финальный, т. е. в такую конфигурацию, в которой осуществляется биологическая
функция.
Альтернативно диффузионно-столкновительный комплекс может распасться без образования финального комплекса. При трансформации
предварительного комплекса в финальный происходят вытеснение молекул растворителя из белок-белкового интерфейса и конформационные
изменения самих макромолекул. Важную роль в этом процессе играют гидрофобные взаимодействия и образование водородных связей
и солевых мостиков[5].
Факторы, регулирующие белок-белковые взаимодействия:
- Концентрация белка, которая, в свою очередь, определяется уровнем экспрессии и скоростью деградации;
- Аффиностью белка к другим белкам или лигандам;
- Концентрация лигандов (субстраты, ионы, и т. д.);
- Присутствие других белков, нуклеиновых кислот и ионов;
- Электрическими полями вокруг белка;
- Присутствие ковалентных модификаций[6].
ДНК-белковые контакты
Устойчивость нуклеопротеидных комплексов обеспечивается нековалентным взаимодействием. У различных нуклеопротеидов в обеспечение стабильности комплекса вносят вклад различные типы взаимодействий. Аланин из-за своей гидрофобности и алифатичности не взаимодействует с ДНК, что подтвердилось при поиске контактов с помощью JMol.
Примечания и источники:
[1] Работа выполнялась вместе с Тепловой Анастасией //
Ее сайт.
[2] Х.-Д. Якубке, Х.Ешкайт Аминокислоты, пептиды, белки. Москва «Мир» 1985, c.13-20 //
LifeBio.wiki.
[3] Аланин //
LifeBio.wiki.
[4] Аланин //
Wikipedia.
[5] Компьютерные исследования и моделирование, 2013, Т. 5 No 1 С. 47−64 // С.С.Хрущевa, А.М.Абатурова и другие //
Моделирование белок-белковых взаимодействий с применением программного комплекса многочастичной броуновской динамики ProKSim.
[6] Белок-белковые взаимодействия //
Wikipedia.
[7] Нуклеопротеиды //
Wikipedia.
[8] Regulation of energy metabolism //
Biocadmin.