Атлас аминокислот: гистидин[1]
Введение
| Тривиальное название | Гистидин / Histidine |
| Трехбуквенный код | His |
| Однобуквенный код | H |
| Название по IUPAC | L-α-амино-β-имидазолилпропионовая кислота |
| Структурная формула | 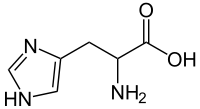 |
| Брутто-формула | C₆H₉N₃O₂ |
| Молярная масса | 155,16 г/моль |
| Химические характеристики | гидрофильный, протонируемый, ароматический |
| PubChem CID | 6274 |
| Заменимость | Незаменимая |
| Кодируется | CAU и CAC |
| Изображение в шариково-стержневой модели с подписанными именами тяжелых атомов |  |
| Вращение: | |
| Тяжелые атомы: | |
| Водород: | |
Гистидин представляет собой альфа-аминокислоту с имидазольной функциональной группой.
Гистидин был открыт немецким врачом Косселем Альбрехтом в 1896 году. Изначально полагалось,
что эта аминокислота незаменима только для младенцев, однако в ходе долгосрочных исследований
было установлено, что она также важна и для взрослых людей. Для человека суточная потребность
в гистидине 12 мг на кг веса.
Вместе с лизином и аргинином образует группу основных аминокислот. Входит в состав многих ферментов,
является предшественником в биосинтезе гистамина. В большом количестве содержится в гемоглобине.
Кольцо имидазола у гистидина является ароматическим при всех значениях рН. Оно содержит шесть
пи-электронов: четыре из двух двойных связей, и два из пары азота. Оно может формировать пи-связи,
однако это осложняется его положительным зарядом. При 280 нм оно не способно поглощать, однако в
нижней части УФ-диапазона оно поглощает даже больше, чем некоторые аминокислоты.
Гистидином богаты такие продукты как тунец, лосось, свиная вырезка, говяжье филе, куриные грудки,
соевые бобы, арахис, чечевица, сыр, рис, пшеница.
Было показано, что добавки гистидина вызывают быстрое выделение цинка у крыс при увеличении
скорости экскреции от 3 до 6 раз[2].
Биохимия
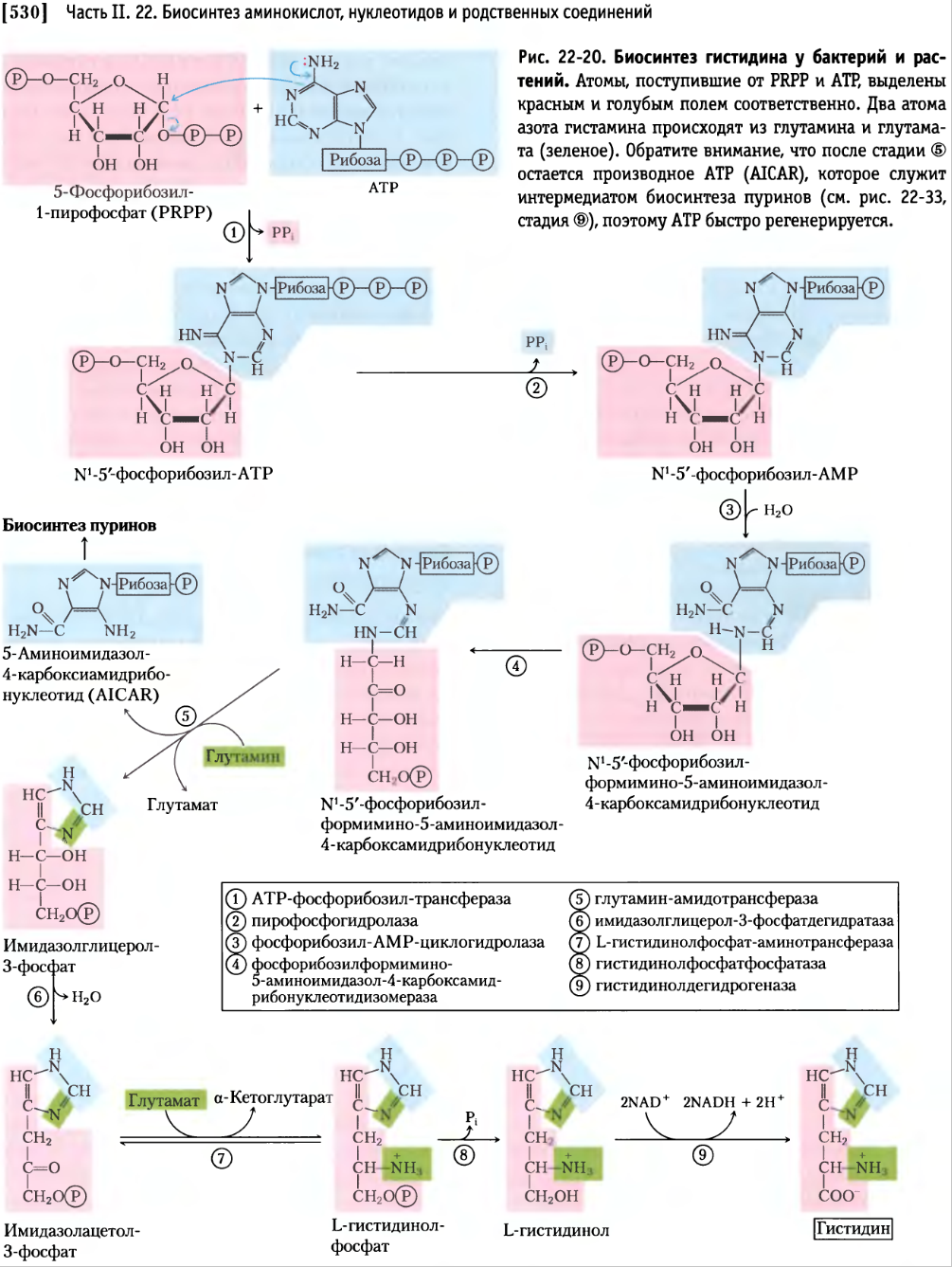 |
Предшественником гистидина, как и триптофана, является фосфорибозилпирофосфат.
Путь синтеза гистидина пересекается с синтезом пуринов.
Имидазольная боковая цепь гистидина является общим координирующим лигандом в металлопротеинах и частью
каталитических центров у определенных ферментов. В каталитических триадах основный азот гистидина
используется для получения протона из серина, треонина или цистеина, и активации его в качестве нуклеофила.
Гистидин используется для быстрого трансфера протонов, абстрагируя протон с его основным азотом, и создавая
положительно заряженные промежуточные вещества, а затем используя другую молекулу, буфер, чтобы извлечь протон
из азотной кислоты. В карбоангидразе гистидинный протонный трансфер используется для быстрого транспортирования
протонов из цинк-связанной молекулы воды, чтобы быстро регенерировать активные формы фермента. Гистидин также
присутствует в гемоглобиновых спиралях Е и F. Гистидин помогает стабилизировать оксигемоглобин и дестабилизировать
CO-связанный гемоглобин. В результате, в гемоглобине связывание окиси углерода сильнее только лишь в 200 раз, по
сравнению с 20 000 раз в свободной геме.
Некоторые аминокислоты могут быть превращены в промежуточные соединения в цикле Кребса. Углероды из четырех
групп аминокислот образуют промежуточные вещества цикла – альфа-кетоглютарат (альфа-КТ), сукцинил-КоА, фумарат
и оксалоацетат. Аминокислоты, образующие альфа-КГ - глутамат, глутамин, пролин, аргинин и гистидин. Гистидин
преобразуется в формиминоглютамат (FIGLU).
Аминокислота является предшественником гистамина и биосинтеза карнозина.
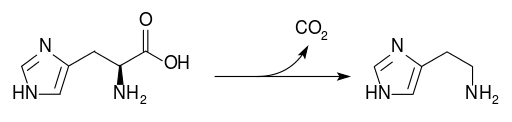 |
Гистидин входит в состав активных центров множества ферментов, является предшественником в биосинтезе гистамина (см. рис.2).
Фермент гистидин аммиаклиазы преобразует гистидин в аммиак и уроканиновую кислоту. Недостаток этого фермента
наблюдается при редком метаболическом расстройстве гистидинемии. В антинобактерии и нитчатых грибах, таких как
Neurospora сrаssа, гистидин может быть преобразован в антиоксидант эрготионеин[2].
Основные функции:
• синтез белков;
• поглощение ультрафиолетовых лучей и радиации;
• производство красных и белых кровяных телец;
• выработка гистамина;
• выделение эпинефрина;
• секреция желудочного сока;
• антиатеросклеротическое,
• гиполипидемическое действие;
• выведение солей тяжелых металлов;
• здоровье суставов.
Системы и органы:
- органы ЖКТ;
- печень;
- надпочечники;
- костно-мышечная система;
- нервная система (миелиновые оболочки нервных клеток).
Последствия дефицита:
- ослабление слуха;
- задержка умственного и физического развития;
- фибромиалгия.
Болезни:
- гистидинемия.
Последствия избытка: Избыток гистидина может способствовать возникновению дефицита меди в организме.
Физико-химические свойства
| Вращение: | |
| Тяжелые атомы: | |
 |
Имидазольная боковая цепь гистидина имеет рКа около 6,0.
Это означает, что при физиологически соответствующих значениях рН, относительно небольшие
изменения в рН могут изменять средний заряд цепи. При рН ниже 6 имидазольное кольцо является в
основном протонированным, как в уравнении Хендерсона-Хассельблаха. При протонировании кольцо
имидазола имеет две NH связи и положительный заряд. Положительный заряд равномерно распределяется
между двумя атомами азота.
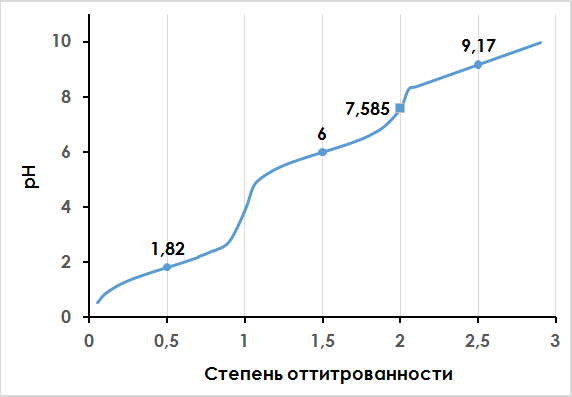
На рис.3 представлена кривая титрования гистидина (файл Excel с вычислениями). Из кривой титрования следует, что остовная карбоксильная
группа имеет рКa1=1,82, протонированная аминогруппа амидазола — рКa2= 6,00, а
остовная протонированная аминогруппа — рКa3=9,17. При рН = 7,58 гистидин
существует в виде биполярного иона (цвиттер-иона), когда суммарный электрический заряд молекулы равен 0. При
этом значении рН молекула гистидина электронейтральна. Такое значение рН называют изоэлектрической точкой
и обозначают рI. Изоэлектрическая точка рассчитывается как среднее арифметическое двух соседних значений рКa.
Для гистидина: рI= ½ *c(рКa2 + рКa3) = ½ * (6,00 + 9,17) = 7,58.
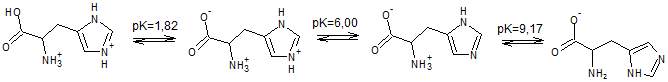 |
На рис.4 показаны разные формы существования молекулы гистидина. Это стоит понимать так: при определенном рКa появляется соответствующая форма, и затем процент ее содержания постепенно увеличивается.
Белок-белковые контакты
| Вращение: | Тяжелые атомы: | ||
| Измерения: | |||
| Скрипт | |||
Вы увидите (по порядку):
1) шаро-стержневая модель гистидина (до нажатия каких-либо кнопок)
2) общий вид пептидной связи на примере гистидина и глицина (PDB ID:1W4S, [HIS]198 и [GLY]199)(после нажатия "Запустить")
3) общий вид остовной водородной связи на примере гистидина и валина (PDB ID:1W4S, [HIS]974:A и [VAL]964:A) (после нажатия "Продолжить")
4) водородная связь с участием боковой цепи (PDB ID:5EC4, [HIS]119 и [GLN]100) (здесь и далее после следующих нажатий "Продолжить")
5) водородная связь с участием боковой цепи (PDB ID:5EC4, [HIS]93 и [GLU]72)
6) водородная связь с участием боковой цепи (PDB ID:5HBS, [HIS]48 и [ASP]63)
7) водородная связь с участием боковой цепи (PDB ID:5HBS, [HIS]137 и [HIS]135)
8) водородная связь с участием боковой цепи (PDB ID:5E9N, [HIS]219 и [TYR]284)
9) водородная связь с участием боковой цепи (PDB ID:3X2M, [HIS]112 и [SER]14)
10) солевой мостик (PDB ID:1us0, [HIS]240 и [ASP]284)
11) солевой мостик (PDB ID:1US0, [HIS]187 и [GLU]185)
12) возможное стэкинг-взаимодействие (PDB ID:5E9N, [HIS]137 и [TYR]7)
13) возможное стэкинг-взаимодействие (PDB ID:5E9N, [HIS]10 и [PHE]50)
Гистидин способен образовывать не только водородные связи с участием остова, но и с участием боковой цепи. Кроме того, из-за
полярности молекулы возможно образование солевых мостиков с отрицательно заряженными аминокислотами (схематично
показаны желтым). Также ароматический гистидин может вступать в стэкинг-взаимодействия с другими ароматическими аминокислотами.
В гидрофобные взаимодействия гистидин не вступает из-за своей гидрофильности.
Белок–белковые взаимодействия лежат в основе многих физиологических процессов, связанных с ферментативной активностью и ее регуляцией,
электронным транспортом и др. Процесс образования комплекса двух белковых молекул в растворе можно условно разделить на несколько стадий:
1) свободная диффузия молекул в растворе на большом расстоянии от других макромолекул,
2) сближение макромолекул и их взаимная ориентация за счет дальнодействующих электростатических взаимодействий с образованием
предварительного (диффузионно-столкновительного) комплекса,
3) трансформация предварительного комплекса в финальный, т. е. в такую конфигурацию, в которой осуществляется биологическая
функция.
Альтернативно диффузионно-столкновительный комплекс может распасться без образования финального комплекса. При трансформации
предварительного комплекса в финальный происходят вытеснение молекул растворителя из белок-белкового интерфейса и конформационные
изменения самих макромолекул. Важную роль в этом процессе играют гидрофобные взаимодействия и образование водородных связей
и солевых мостиков[3].
Факторы, регулирующие белок-белковые взаимодействия:
- Концентрация белка, которая, в свою очередь, определяется уровнем экспрессии и скоростью деградации;
- Аффиностью белка к другим белкам или лигандам;
- Концентрация лигандов (субстраты, ионы, и т. д.);
- Присутствие других белков, нуклеиновых кислот и ионов;
- Электрическими полями вокруг белка;
- Присутствие ковалентных модификаций[4].
ДНК-белковые контакты
 |
Устойчивость нуклеопротеидных комплексов обеспечивается нековалентным взаимодействием. У различных нуклеопротеидов
в обеспечение стабильности комплекса вносят вклад различные типы взаимодействий.
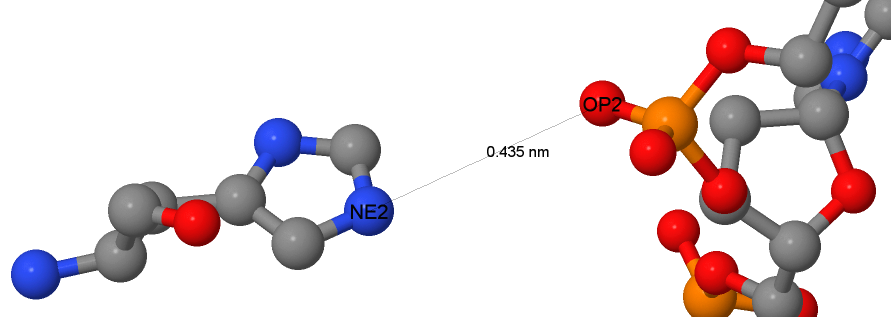
На рис. 5 показано взаимодействие гистидина и фосфатной группы остова ДНК. Это взаимодействие обусловленно
положительным зарядом гистидина. Было найдено множество подобных взаимодействий (все
образованы по единому принципу, поэтому смысла приводить их все нет).
Примечания и источники:
[1] Работа выполнялась вместе с Тепловой Анастасией //
Ее сайт.
[2] Гистидин //
LifeBio.wiki.
[3] Компьютерные исследования и моделирование, 2013, Т. 5 No 1 С. 47−64 // С.С.Хрущевa, А.М.Абатурова и другие //
Моделирование белок-белковых взаимодействий с применением программного комплекса многочастичной броуновской динамики ProKSim.
[4] Белок-белковые взаимодействия //
Wikipedia.
[5] Нуклеопротеиды //
Wikipedia.