практикумы №3-5
PDB, PyMOL
Пиохелинсинтаза PchD Синегнойной палочки (Pseudomonas aeruginosa)
Структура в целом
Тип макромолекулы - белок, в структуре одна полимерная цепь, разделённая на два домена. В одну биологическую единицу входит одна полимерная цепь, с ассиметрической единицей различий нет.
PchD состоит из большой N-концевой субъеденицы (Аcore) и меньшей C-концевоой субъеденицы (Asub) [1].

Полимерная цепь
Белок относится к бактерии Pseudomonas aeruginosa. Мутаций в последовательности относительно референса нет, отсутствуют модифицированные аминокислотные остатки.
PDB: 7TZ4
Uniprot: PCHD_PSEAE общее наименование: PchD

Малые молекулы
Запись PDB содержит малую молекулу 4-цианосалицил-АМС, являющуюся объектом исследования в оргинальной статье. PchD участвует в биосинтезе пиохелина, необходимого для стимуляции роста бактерий. Данная малая молекула является одной из модификаций ингибитора (салицил-АМС) домена аденилирования, которые могут стать терапевтическими препаратами против инфекций синегнойной палочки. Введение нитрильной группы позволило расширить электрофильное салициловое кольцо, которое в теории могло было бы ковалентно связываться с цистеином в активном центре (рис.4, однако исследование показало, что этого не происходит). Белок и ингибитор были синтезированы независимо, а затем со-кристаллизованы.
краткое наименование: KUX, полное: 5'-O-[(4-cyano-2-hydroxybenzoyl)sulfamoyl]adenosine
соответствующие строки в оригинальном файле KUX.pdb



Взаимодействия
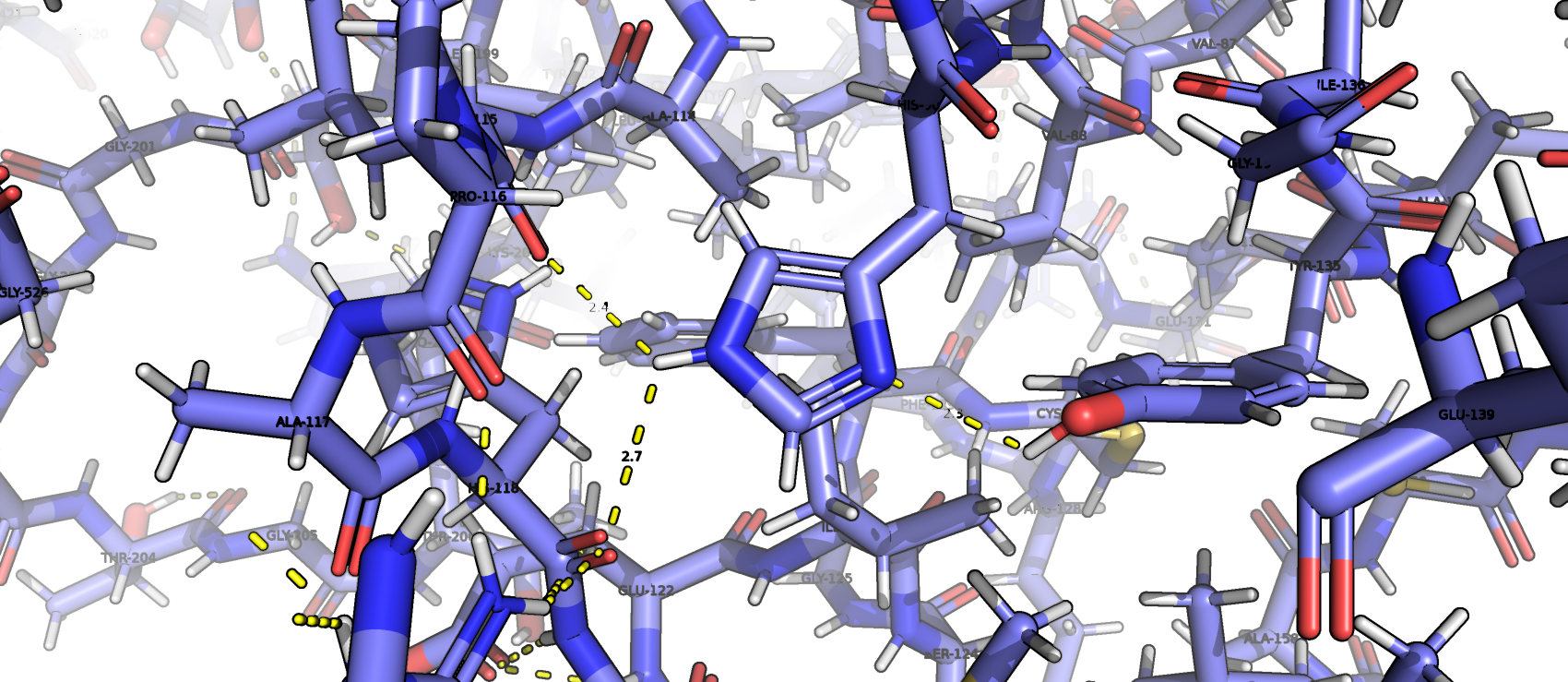
Водородные связи, затрагивающие атомы остова


Водородные связи, затрагивающие атомы боковых радикалов аминокислот
Солевой мостик

Дисульфидная связь
Белок содержит много остатков цистеина, однако ни один из них не связан в дисульфидный мостик. Поскольку цистеиновые остатки распределены по всему белку,
для наглядности удобно скрыть всю остальную структуру (рис. 10, пространственное расположение совпадает с таковым на рис.1). Также примечателен Cys-101,
который имеет странное строение, ведь в аннотации нет информации о модифицированных остатках (рис. 11). Анализ оригинальной статьи и источников не дал ответа,
поэтому предположу, что это ошибка аннотации (смущает валентность бета-углерода, как минимум).


Стекинг


Ферментативная активность
Для PchD в аннотации PDB указан EC: 2.7.7, то есть без последнего подкласса фермента. В аннотации UniProt указан EC:6.2.1.61, возникает противоречие. По первой аннтоции белок является нуклеотидтрансферазой, а по второй - кислотно-тиольной лигазой. Для рассмотрения в практикуме я использую EC:6.2.1.61, поскольку (1) данная классификация дает больше информации и (2) на мой взгляд лучше соответствует описанию ферментативной активности белка в оригинальной статье.
Белок PchD участвует в биосинтезе сидерофора пиохелина, в частности аденилирует салицилат (первая реакция синтеза пиохелина, рис. 14) и присоединяет его к голоформе белка PchE посредством тиоэфирной связи с фосфопантетеиновой частью. То есть данный фермент активирует салицилат и переносит соединение на белок-переносчик арила.

Каталитически важными являются остатки His-244 и Lys-529, которые придерживают кислороды в лиганде* (рис.15). Аминокислоты активного центра не взаимодействуют между собой, на расстоянии 5А от них же взаимодействие наблюдается только между His-244 и Phe-246 (рис.16). Расстояние, на котором молекула ингибитора расположена относительно активного может быть определено как длина водородных связей между атомами ингибитора и каталитически важных аминокислот, то есть около 2-2,5 ангстрем.


*Является некоторым упрощением, поскольку в аннотации не приведены active site.
Источники:
- Оригинальная статья (Shelton C. L. et al. Rational inhibitor design for Pseudomonas aeruginosa salicylate adenylation enzyme PchD //JBIC Journal of Biological Inorganic Chemistry. – 2022. – Т. 27. – №. 6. – С. 541-551)