Практикум 10
Задание 1
Выбранный белок
В данном задании я работал с коагулазой PLA бактерии-возбудителя чумы Yersinia pestis (PDB ID: 2x55; UniProt ID: COLY_YERPE; Plasminogen activator PLA (coagulase/fibrinolysin)). Этот белок является протеазой и катализирует расщепление плазминогена с образованием плазмина, который в свою очередь запускает каскад свертывания крови. Эта активность фермента важна для вирулентности патогена. Также было показано, что PLA имеет высокое сродство к фибронектину и, таким образом, участвует в адгезии бактериальных клеток к клеткам хозяина (Eren et al., 2010).
База данных OPM
Информация о структуре трансмембранных участков выбранного белка, взятая из базы данных OPM, представлена в таблице ниже (Табл. 1).
С помощью пакета nglview для языка python было получено изображение, отражающее положение белка в мембране (Рис. 1).
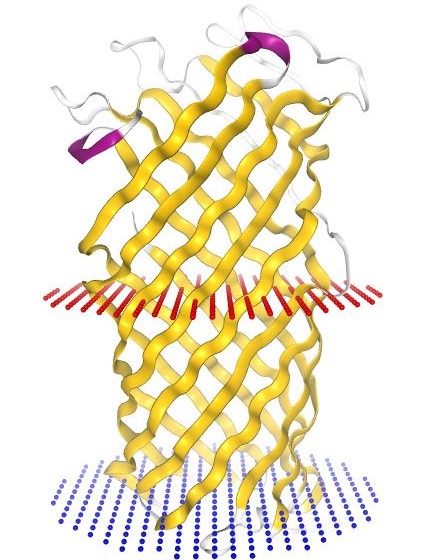
Красными шариками отмечена наружная поверхность мембраны, синими - внутренняя.
| Толщина гидрофобной части белка в мембране | 25.6 Å |
| Координаты трансмембранных участков | 1(13-22),2(51-60), 3(65-73),4(111-121), 5(126-136),6(174-183), 7(188-197),8(224-235), 9(239-248),10(282-292) |
| Среднее число остатков в β-тяже | 10.4 остатка |
| Тип мембраны | Внешняя мембрана Грам-отрицательной бактерии |
Задание 2
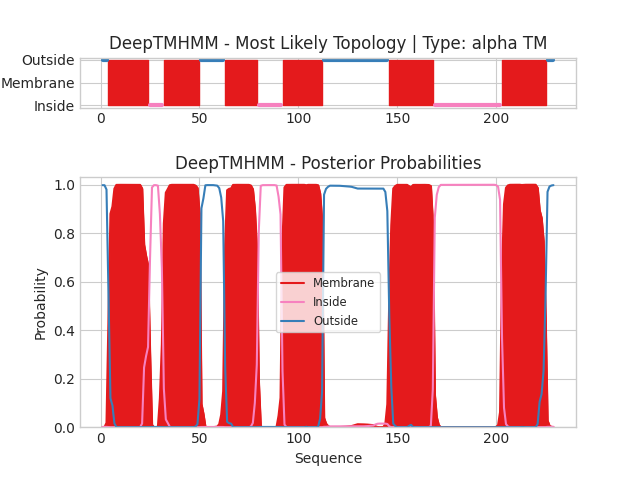
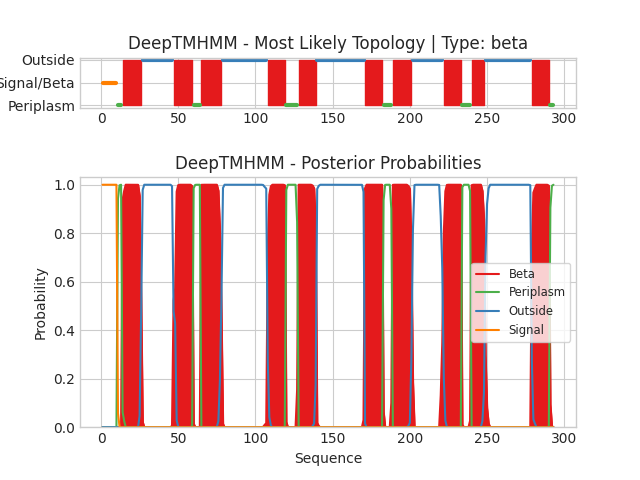
Данное задание состояло в использовании сервера DeepTMHMM для предсказания трансмембранных участков в исследуемых белках CIDB_STAAC (альфа-спиральный) и COLY_YERPE (бета-листовой).
Результаты работы сервера в текстовом виде доступны по данным ссылкам:
Графическая выдача представлена на рисунках ниже (Рис. 2, 3).
По оси X в каждом из графиков отложена позиция в первичной последовательности белка (номер остатка начиная с N-конца). По оси Y в верхнем графике (на обеих картинках) отложено наиболее вероятное положение аминокислотного остатка по отношению к мембране, а в нижнем - вероятность каждого из положений. Цвет линий в обоих случаях отражает положение данного участка цепи (красный: в толще мембраны, синий: с наружной стороны, розовый или зеленый: с внутренней).
Задание 3
Выданный мне белок
В качестве альфа-спирального белка с неизвестным положением в мембране был взят холин-подобный белок CidB золотистого стафилококка Staphylococcus aureus штамма COL (UniProt ID: CIDB_STAAC; Holin-like protein CidB). Этот белок способен мультимеризоваться, образуя поры в мембране бактерии, что способствует экспорту из цитоплазмы ферментов, разрушающих клеточную стенку (Rice et al., 2003). В названии упомянут фаговый белок холин со схожей функцией.
Предсказание положения белка в мембране
В данном задании положение выданного мне альфа-спирального белка CIDB_STAAC в мембране было предсказано с помощью сервера PPM 3.0.
При запуске анализа на сервере тип мембраны был взят за "Gram-positive bacteria inner membrane", так как золотистый стафилококк относится к Грам-положительным бактериям. Был оставлен запрет на изгибы мембраны (белок маленький, ими точно можно принебречь), положение N-конца было взято за "out" в соответствии с предсказанием сервера DeepTMHMM (Рис. 2, началу цепи соответствует синий цвет линии).
Параметры трансмембранных участков белка согласно серверу PPM приведены в таблице ниже (Табл. 2). На рисунке (Рис. 4) изображено предсказанное положение белка в мембране (структура из pdb файла, входящего в выдачу).

Красными шариками отмечена наружная поверхность мембраны, синими - внутренняя.
| Толщина гидрофобной части белка в мембране | 29.7 Å |
| Координаты трансмембранных участков | 1(3-25),2(30-50), 3(57-80),4(89-115), 5(121-129),6(146-168), 7(177-188),8(202-225) |
| Среднее число остатков в α-спирали | 20.4 остатка |
| Тип мембраны | Мембрана Грам-положительной бактерии |
Задание 4
Для начала сравним разные предсказания трансмембранных участков, полученные для альфа-спирального белка CIDB_STAAC. Если сопоставить график на Рис. 1 с 2 с данными Табл. 2, можно увидеть, что алгоритм, используемый сервером DeepTMHMM, "не увидел" два погруженных в мембрану участка, найденных сервером PPM (участки 5 и 7 из таблицы, попадающие в 2 крупных "окна" на графике). Что интересно, судя по предсказанной AlphaFold структуре, эти участки соответствуют двум фрагментам "спираль-изгиб-спираль", которые заходят в мембрану, но не пронизывают ее насквозь. Данные участки имели уровень достоверности предсказания структуры "Very high", поэтому, вероятно, имеет смысл больше верить результатам AlphaFold и PPM.
Для белка COLY_YERPE сервер DeepTMHMM предсказал 10 трансмембранных бета-тяжей, что соответствует его структуре из базы данных PDB, полученной экспериментально методом рентгеноструктурного анализа. При этом координаты найденных трансмембранных участков примерно совпадают с указанными в базе данных OPM. Таким образом, в данном случае предсказание DeepTMHMM является достаточно точным.
Литература
- Eren E, Murphy M, Goguen J, van den Berg B.
An active site water network in the plasminogen activator pla from Yersinia pestis.
Structure. 2010 Jul 14;18(7):809-18. PMID: 20637417.
DOI: https://doi.org/10.1016/j.str.2010.03.013 - Rice K, Firek B, Nelson J, Yang S, Patton T, Bayles K.
The Staphylococcus aureus cidAB operon: evaluation of its role in regulation of murein hydrolase activity and penicillin tolerance.
J. Bacteriol. 2003; 185, 2635-43. PMID: 12670989.
DOI: https://doi.org/10.1128/jb.185.8.2635-2643.2003