В данном задании нам было дано 10 PDB структур, последовательности которых демонстрируют не более 40% попарного сходства. Нам нужно было наложить структуры на одну опорную и посмотреть, чем они похожи, а чем различаются.
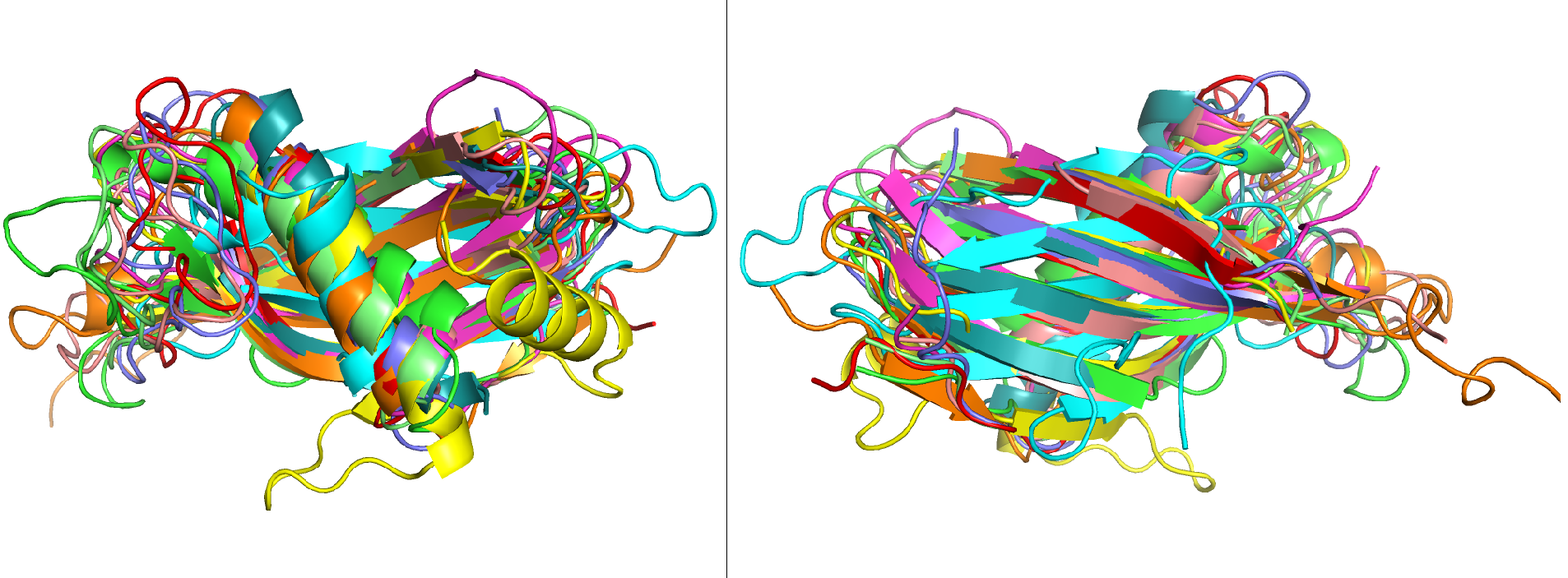
При наложении структур друг на друга с помощью команды super, в качестве опорной была взята структура 1a90A00 (см. рисунок 1.1, показана ярко-зеленым).

Рисунок 1.1. Наслоение моделей структур десяти данных PDB друг на друга. Слева - вид со стороны альфа-спиралей, справа - вид со стороны бета-слоев.
Рассмотрим на примере опорной структуры (рисунок 1.2) элементы вторичной структуры похожие и различающиеся у всех структур.
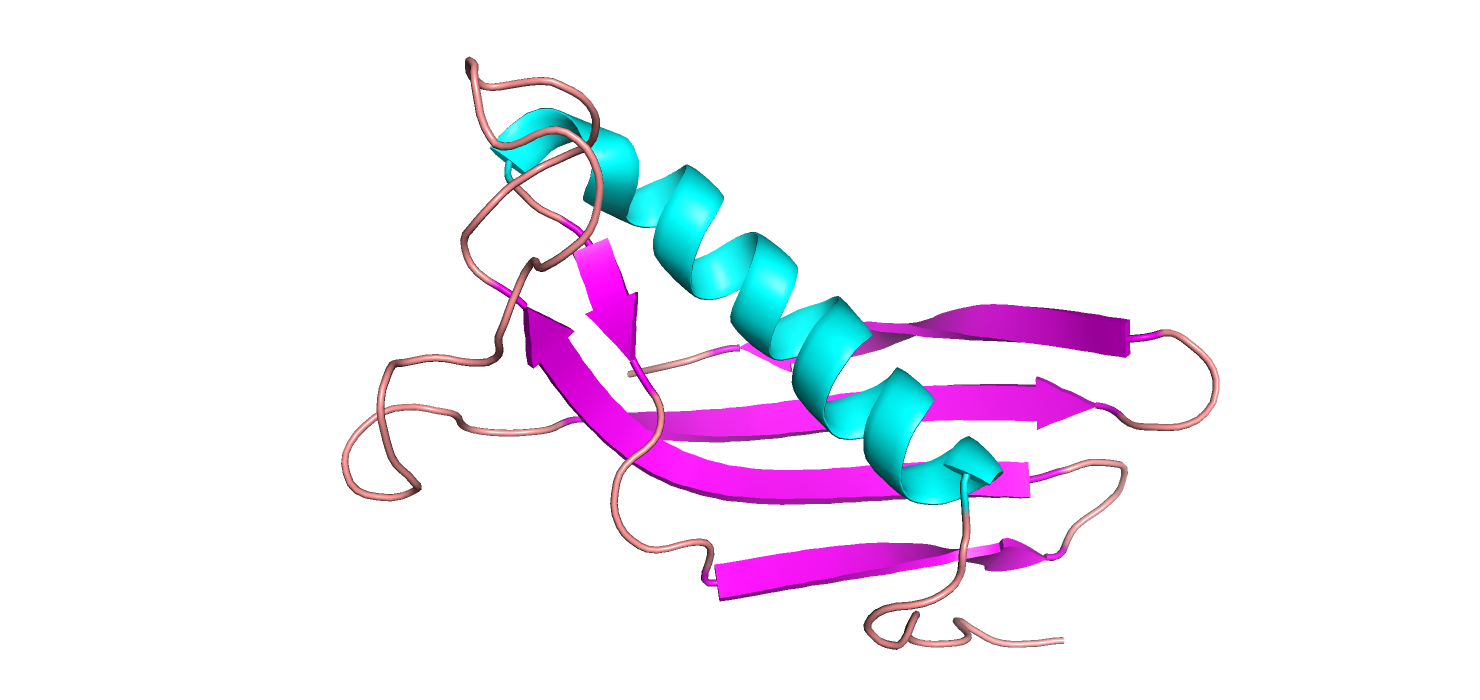
Рисунок 1.2. Структура 1a90A00 (покрашено по типу вторичной структуры).
Итак, для начала нужно отметить, что во всех структурах встречается альфа-спираль, однако только в пяти структурах она такая же длинная (19-39 а.о. опорной структуры), как у опорной: чаще всего она примерно в два раза короче (около 19-30 а.о. опорной структуры). Также в двух структурах, в которых встречается короткие альфа-спирали, концу альфа-спирали опорной структуры соответствуют маленькие альфа-спирали из одного - двух оборотов, соединяющихся петлей с короткой альфа-спиралью (рисунок 1.3, слева). Нужно отметить, что есть одна структура, у которой есть еще одна длинная дополнительная альфа-спираль (рисунок 1.3, справа).
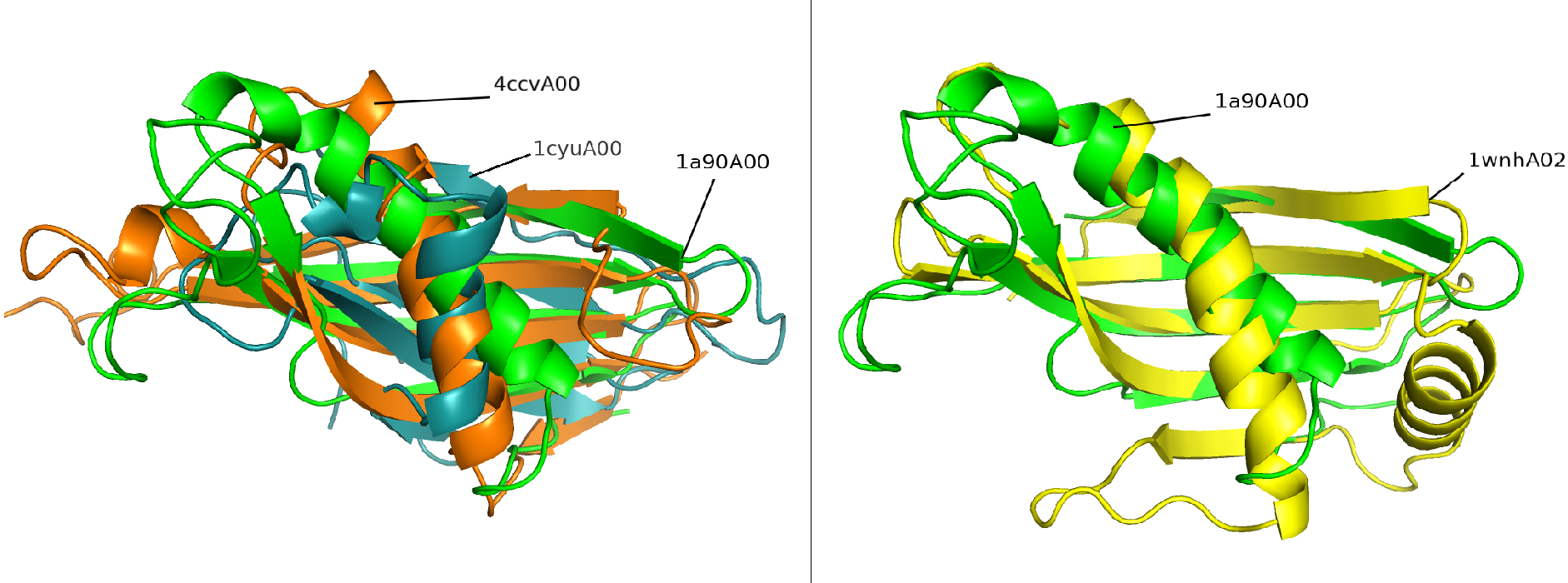
Рисунок 1.3. Слева - наложение структур 4сcvA00, 1cyuA00 на 1a90A00. Справа - наложение структуры 1wnhA02 на 1a90A00.
Далее, посмотрим со стороны бета-слоев. В целом, нужно отметить, что все структуры кроме трех, которые будут упомянуты ниже, имеют практически также расположенные и немного отличающиеся по длине 4 бета-тяжа, объединные в бета-лист (48-54 + 58-69 + 93-102 + 106-114 а.о. для опорной структуры). Обсудим три сильно отличающихс структуры:
(1) 1cyuA00 (рисунок 1.4, слева сверху). Можно заметить, что хоть соответствующие бета-тяжи данной структуры совпадают с опорной по направлению, угол наклона листа очень сильно отличается. Также, можно заметить дополнительный маленький бета-тяж снизу, входящий в состав бета-листа. И, также, сверху виден бета-тяж (на который направлен коннектор), который имеет длину сильно меньшую, чем у опорной структуры.
(2) 1wnhA02 (рисунок 1.4, справа сверху). Тут нужно отметить, что и длина бета-тяжей и угол наклона бета-листа совпадают, однако, во-первых, снизу показан (указан коннектором) также небольшой дополнительный бета-тяж, входящий в бета-лист. Во-вторых, бета-тяж второй снизу на рисунке у данной структуры сильно длиннее, чем у опорной, и, можно заметить, что он соответствует последовательности тяж-петля-тяж у опорной структуры.
(3) 4ccvA00 (рисунок 1.4, снизу слева). В данном случае снова наблюдается дополнительный бета-тяж (снизу), входящий в бета-лист. Также, как и в прошлой структуре, в целом, по углу наклона бета-листа и длине бета-тяжей, совпадает с опорной. Однако, видно, что верхний бета-тяж по сравнению с опорной структурой, укорочен примерно в два раза и, из-за, различий в количестве аминокислотных остатков, у данной структуры далее идет еще один бета-тяж.
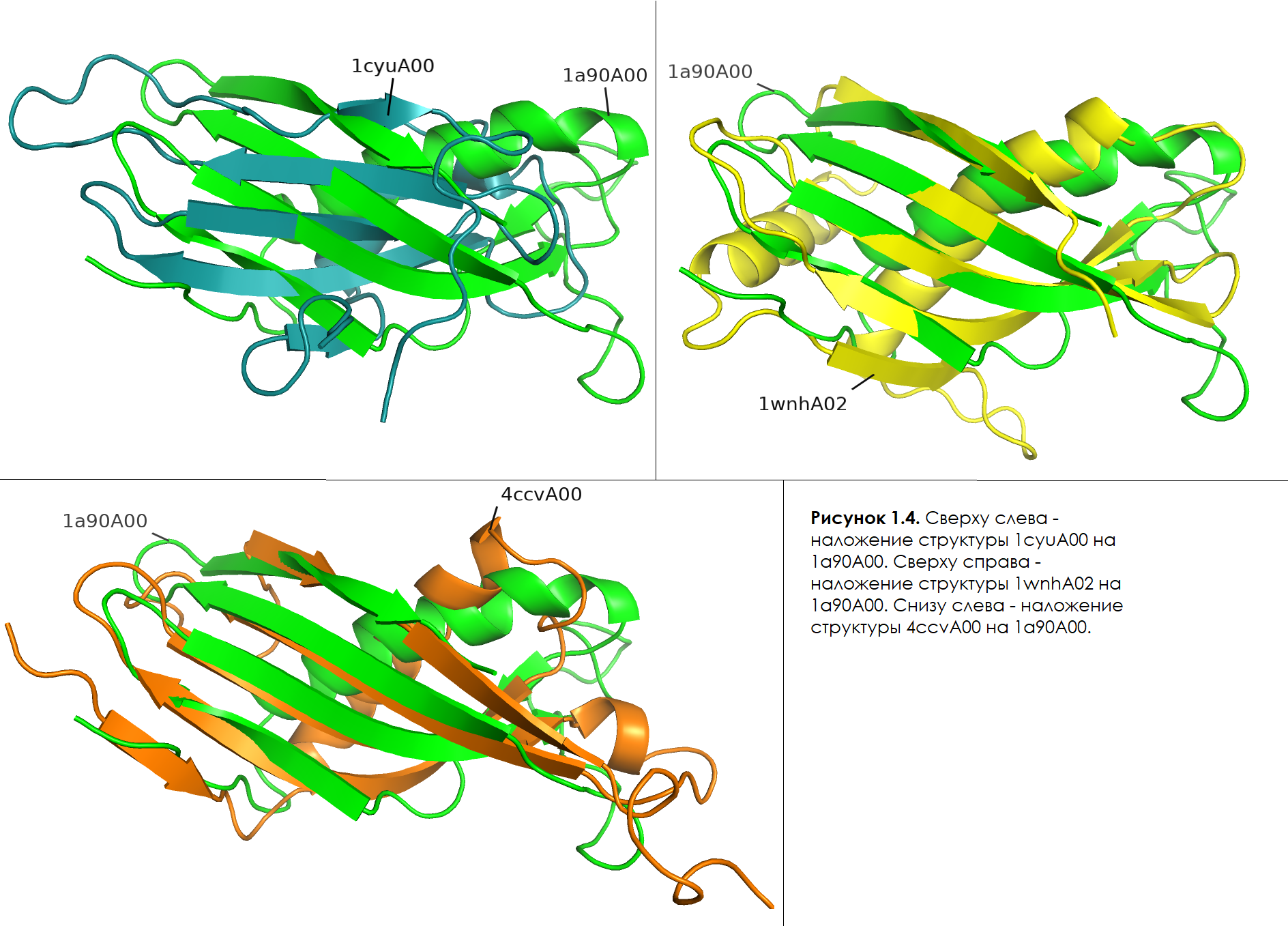
В целом, можно сказать, что все PDB структуры похожи по наличию в них упомянутых выше элементов вторичной структуры, за редкими исключениями. В основном, различия наблюдаются в положении элементов в пространстве, их длине, и наличии небольших дополнительных или отсутствии кусков некоторых элементов вторичной структуры. Также, естественно, возникали различия из-за количества аминокислотных остатков в белке, что порождало или редуцировало элементы структуры.
В данном задании нужно было для любой PDB пары изучить разметку вторичной структуры, которую Pymol сделал по умолчанию (внутри он использовал dssp), найти участок, в котором участок одного белка, проходя через то же место в пространстве, что и аналогичный участок второго белка, имеет отличную от него разметку вторичной структуры и объяснить, оправдано ли это различие.
Различия в разметке вторичной структуры будем рассматривать на примере петлевого участка структуры 2ch9A01 (139-140 а.о.) и участка бета-тяжа структуры 3lh4A00 (106-107 а.о.)(см. рисунок 2.1).
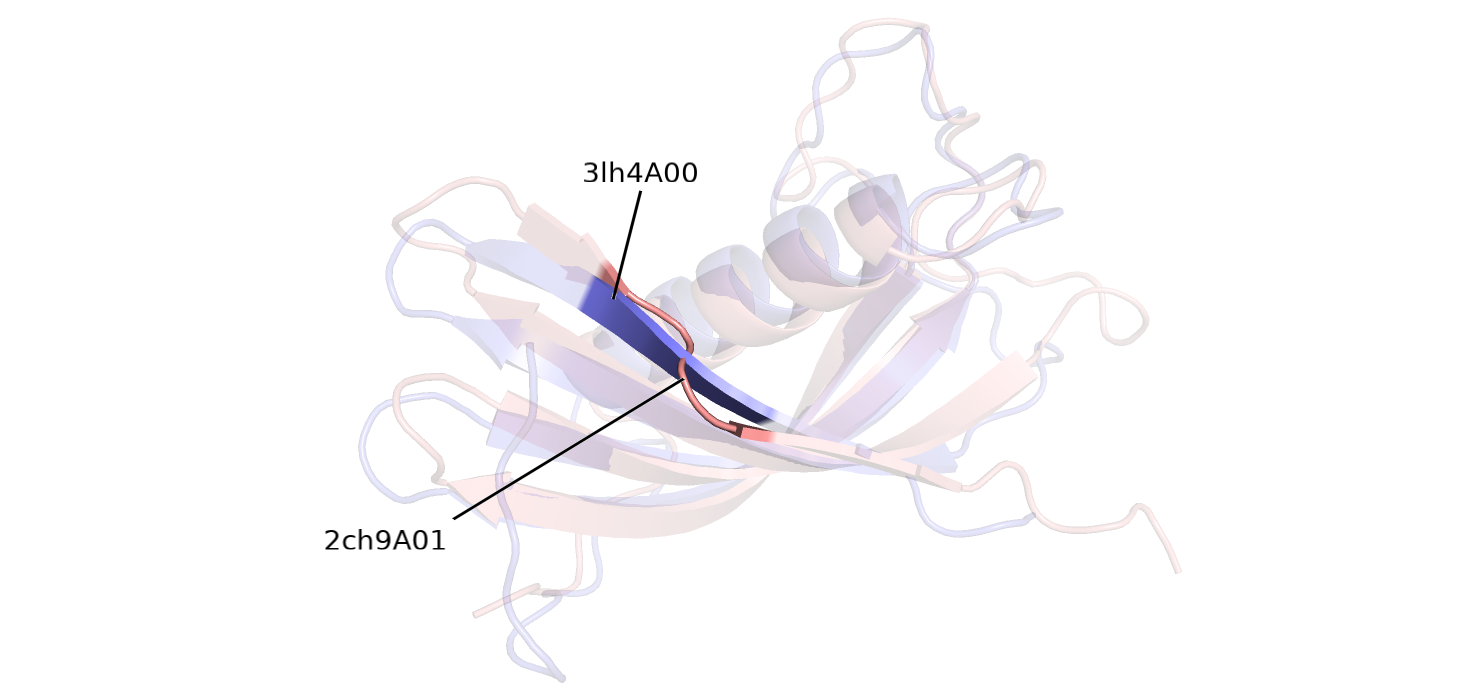
Рисунок 2.1.Наложение структуры 3lh4A00 на 2ch9A01.
Для начала стоит отметить, что так как в некоторых случаях алгоритмы разметки не включают граничные остатки вторичных структур в их состав, я рассматривала дополнительно остатки по краям интересующей нас петли.
Мы по очереди проанализируем длины водородных связей, торсионные углы и закрученность бета-листа для каждой из ситуаций.
(1) Длины водородных связей и закрученность. В случае структуры 2ch9A01 (розовая, рис. 2.2, сверху), в которой наблюдалась петля (ярко-розовый) сразу понятно, почему она там возникает: мы видим PRO-140, который не может образовывать водородную связь с нижележащим бета-тяжем, а также, который искривляет ход цепи. И таким образом, мы видим водородные связи сбоку от VAL-139 и PRO-140, а там, где эти остатки находятся, связей нет. Да и вообще, вместо этих двух остатков, для того, чтобы был бета-тяж, должен быть один. Далее мы можем посмотреть на закрученность. Взяв в качестве i-го остатка VAL139, мы увидим, что здесь правозакрученная цепь, а чтобы быть бета-листом, она должна быть ровно на столько левозакрученная; если взять в качестве i-го остатка PRO-140, мы получим закрученность 39,4 градуса, следовательно, в данном случае цепь тоже правозакрученная и далека от нормы (не показано на рисунке для отсутствия загроможденности). В связи со всем вышесказанным мне кажется, что здесь разметка сделана правильно и, действительно, в данной струкутре находится именно петля. Теперь перейдем ко второй струкутре - 3lh4A00 (фиолетовая, интересующий кусок бета-тяжа показан синим) на рисунке 2.2, снизу.
Первое, что следует отметить - это то, что в целом, длины водородных связей находятся в пределах нормы за исключением связи между SER-108 и VAL-95. Также, в глаза бросается, что картина водородных связей совсем не характерна для бета-мостиков антипараллельного бета-листа: SER-107 как будто неправильно повернут, из-за чего его С атом смотрит не в ту сторону и нарушается ход цепи водородных связей. Что касается закрученности синего тяжа, она находится около нормы (-163 градуса), если взять в качестве i-го остатка ILE-106 и является левозакрученной, а если взять в качестве i-го остатка SER-107, то закрученность будет -10,9 градусов (не показано на рисунке для отсутствия загроможденности) - это также левозакрученный бета-тяж, однако, значение параметра в 15 раз меньше, чем должно быть в норме.
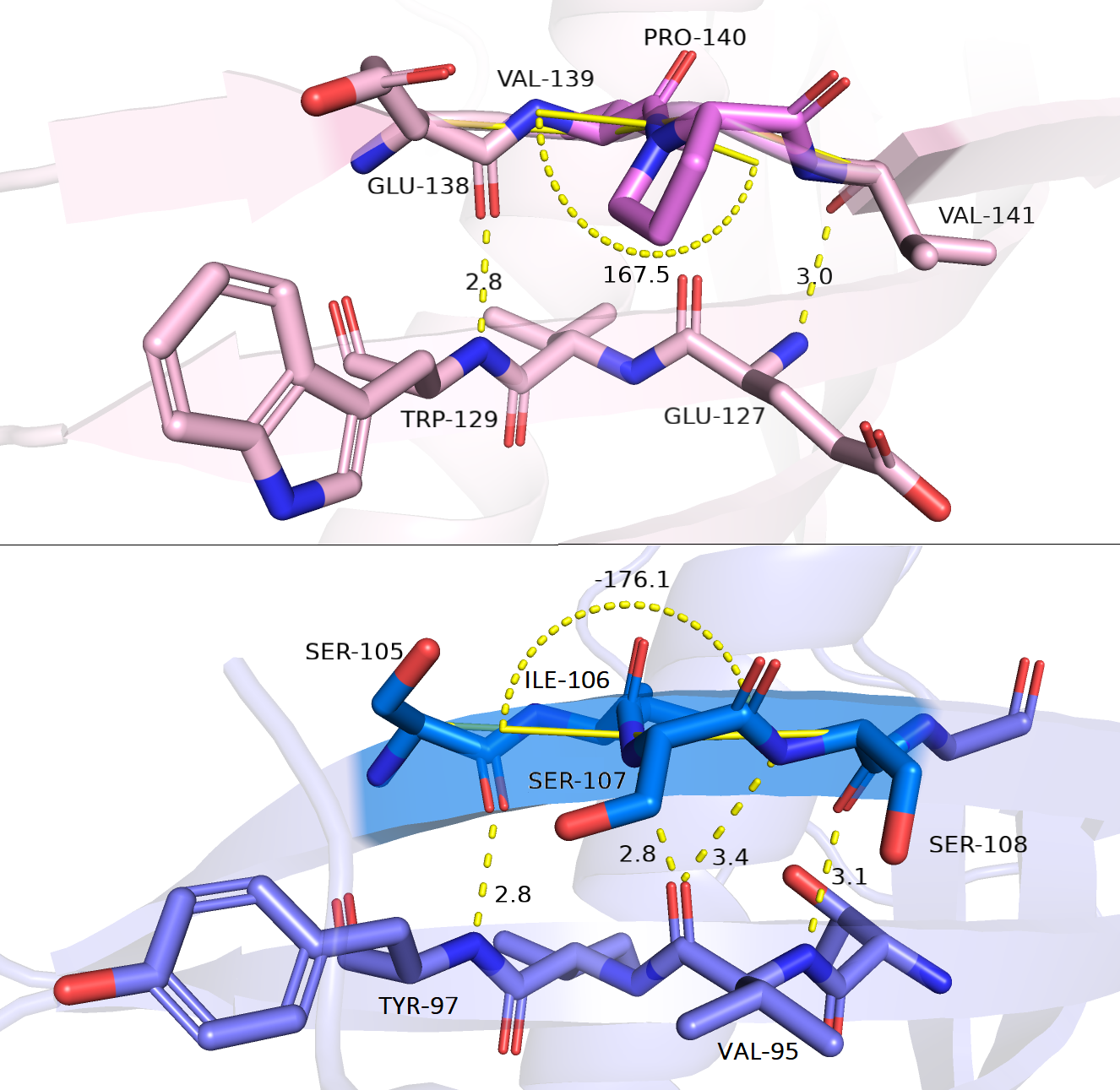
Рисунок 2.2.Сверху - структура 2ch9A01 (розовая), ярко-розовым показана интересующая петля; снизу - структура 3lh4A00 (фиолетовая), синим показаны остатки, соответствующие петле розовой структуры.
(2) Торсионные углы. Так как очевидно, что яркий кусок розовой структуры 2ch9A01 - это уже точно петля, будем рассматривать торсионные углы на 'бета-листе' 3lh4A00 (рисунок 2.3, φ - желтые, ψ - зеленые). В норме, угол φ должен составлять около -100 градусов, а угол ψ - около +120 градусов. На рисунке ниже мы видим, что как раз там, где находится SER-107, обсуждавшийся выше, торсионные углы φ = -68,9 градусов и ψ = -36,6 градусов очень далеки от нормы. И по этой же причине φ SER-108 почти в полтора раза меньше нормы. Учитывая все вышесказанное я думаю, что все же в обеих структурах должны быть петли, так как в случае структуры с бета-тяжем вместо петли много параметров, обсужденных выше, отклоняется от нормы.
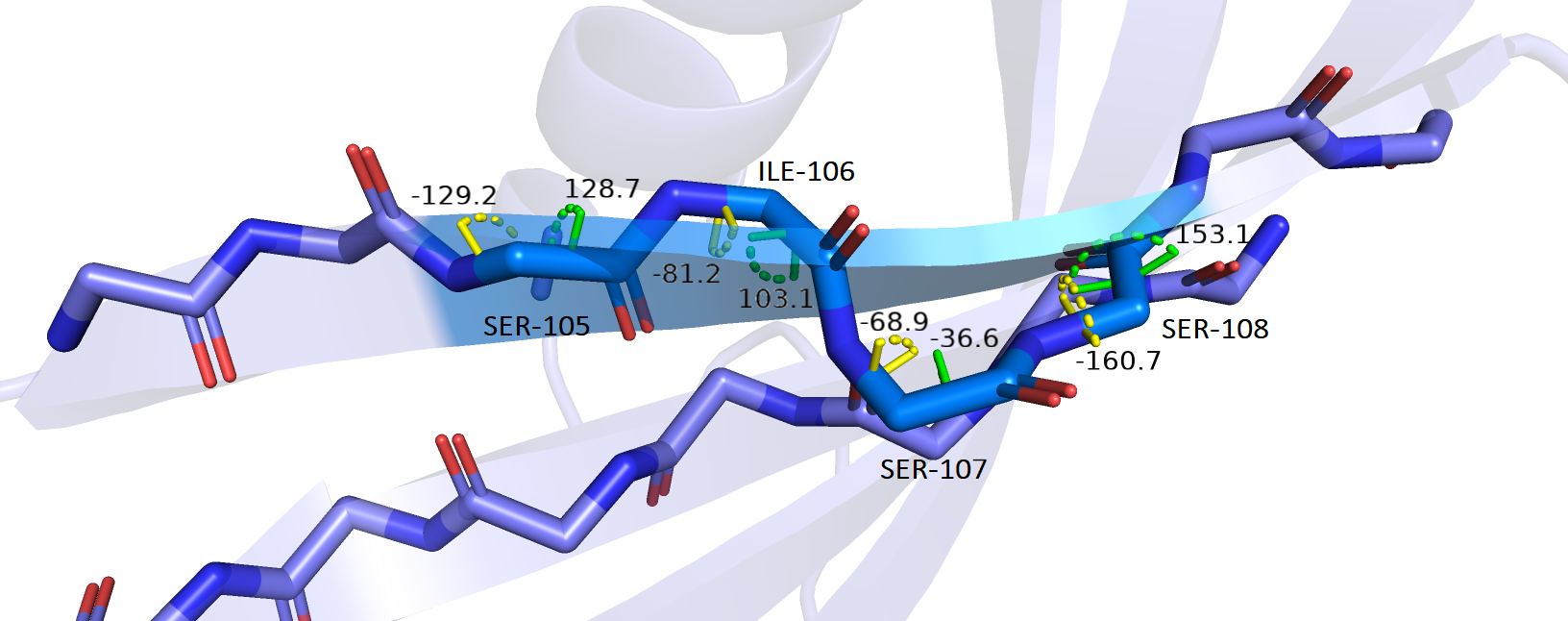
Рисунок 2.3.Торсионные углы структуры 3lh4A00 (фиолетовая), синим показаны остатки, соответствующие петле розовой структуры, углы φ показаны желтым, углы ψ - зеленым.
В этом задании нужно было для каждого из 10 PDB сгенерировать разметку вторичной структуры с помощью dssp, и рассчитать склонность каждого типа аминокислоты образовывать тот или иной тип вторичной структуры (amino acid secondary structure propensity):
Сайт находится на этапе разработки.
P_ik = (n_ik/n_i)/(N_k/N), где
P_ik - это propensity аминокислотного остатка i образовывать тип вторичной структуры j; n_ik - это количество остатков i в датасете, образующих тип вторичной структуры j; n_i - это общее количество остатков i в датасете; N_k - это общее количество остатков, образующих тип вторичной структуры j во всем датасете; N - это общее количество остатков в датасете.
Ссылка на таблицу Excel с промежуточными и финальными данными. Таким образом, можно сделать вывод, что: остатки, которые заметно чаще образует альфа-спирали, чем бета-листы и петли - это T, A (в порядке убывания); остатки, которые заметно чаще образует бета-листы, чем альфа-спирали и петли - это С, V, I; и, наконец, остатки, которые заметно чаще образует петли, чем альфа-спирали и бета-листы - это G и P.
© Бруман Софья, 2020