1. Молекула LAC-репрессора (цепи A,B,C)
2. Молекула ДНК (цепи D и E)
Для исследования были выбраны цепи A и B белка и цепи D и E, представляющие ДНК со следующей последовательностью:
цепь D [5] 5' - tgtgagcgctcacatt - 3' [21]
||||||||||||||||
цепь E [2] 3' - acactcgcgagtgtaa - 5' [18]
Таблица. Контакты разного типа в комплексе 1efa.pdb
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 0 | 34 | 34 |
| остатками фосфорной кислоты | 15 | 7 | 22 |
| остатками азотистых оснований со стороны большой бороздки | 14 | 20 | 34 |
| остатками азотистых оснований со стороны малой бороздки | 4 | 7 | 11 |
Из данных таблицы видно, что лучше всего белок контактирует с остовом ДНК, причём полярные контакты характерны для остатка фосфорной кислоты, а неполярные - для остатка рибозы. С большой бороздкой контактов больше, чем с малой, по-видимому, в большой бороздке происходит специфическое ДНК-белковое связывание.
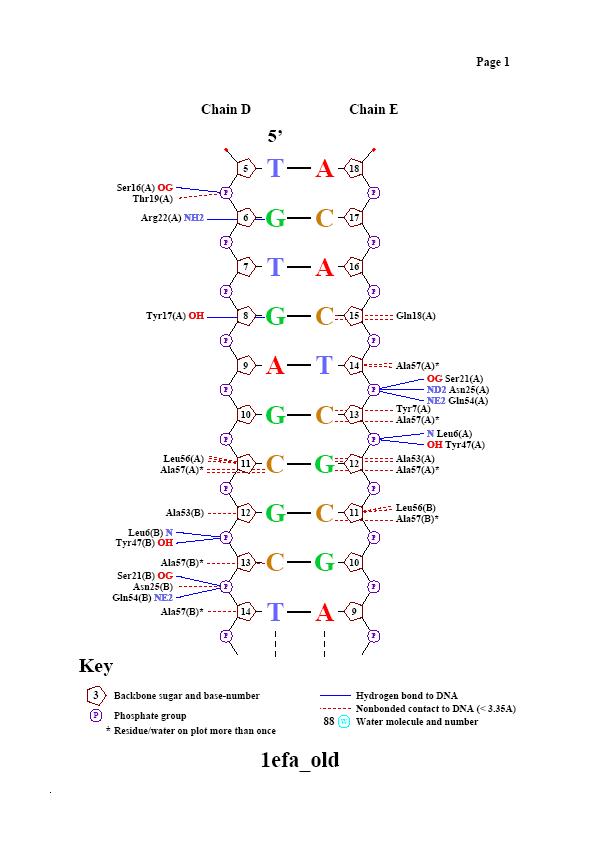
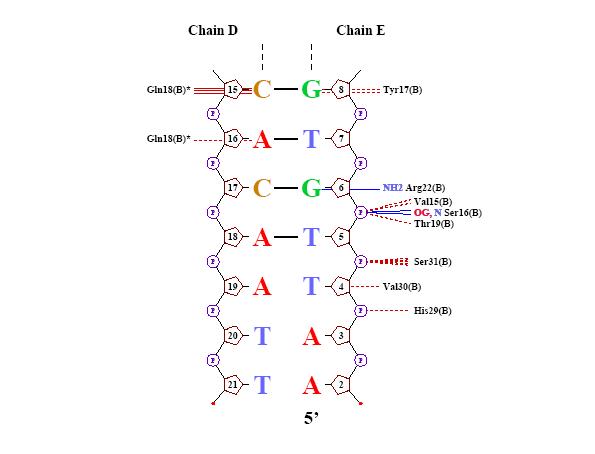
Комментарии: Программа выдаёт 18 контактов с остатком фосфорной кислоты и 8 контактов с остатком дезоксирибозы, в то время, как RasMol, по заданным ему параметрам определения связей находил 22 и 34 контакта соотвественно. Видимо, дело в том, что программа nucplot ищет связи между аминоскислотами и основаниями, принимая во внимание предпочтительность одних связываний другим (например, известно, что Lys часто связывается с T, Gln - c A), а мы искали непоследственно контакты между атомами, основываясь на их отдалённости друг от друга. Из картинки следует, что с основаниями возникает 13 контактов. Выбранный нуклеотид G8 на D цепи (как самый "кривой" с точки зрения торсионных углов), контактирует с Tyr17, что, возможно, и послужило причиной изменения его положения. Аналогичный нуклеотид на А16 на цепи Е, согласно nucplot, контатов с аминокислотами не образует.
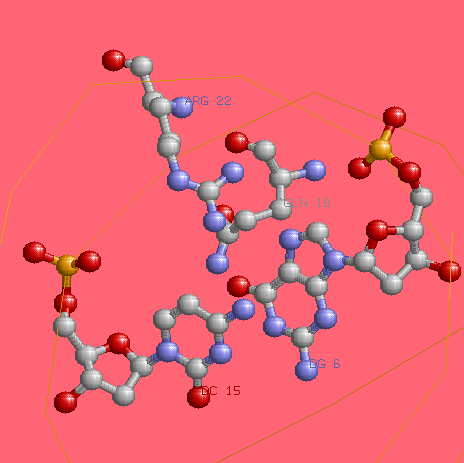
На картинке жёлтым цветом выделен остов ДНК, раскраска задана по атомам.

Огромное количество бактериальных транскрипционных регуляторов связывается с ДНК с помощью HTH(helix-turn-helix)-мотива. Эти белки очень различны, но для удобства их можно разделить на группы, опираясь на сходство их последовательностей. Одной из подобных групп является объединение таких семейств белков, как ascG, ccpA, cytR, ebgR, fruR, galR, galS, lacI, malI, opnR, purF, rafR, rbtR и scrR. Для всех семейств этой группы характерно наличие N-концевого НТН-мотива.