|
Gene Ontology
-
Рассматривался набор ID из файла list39.txt,
в нём находится 21 ID.
-
В анализе обогащения GO категорий участвовало 22 ID: все ID из списка, кроме
PPOX, были одназначно опознаны, при этом PPOX был неоднозначно интерпретирован
как орексин и как оксидаза протопорфириногена.
-
В результате анализа обогащения
была определена 61 GO категория, статистически ассоциированная с представленным
набором ID. Категории отбирались по порогу уровня значимости, были отображены
лишь находки с FDR < 0.05.
-
Список 10 самых значимых находок (по возрастанию FDR):
| Number | GO term code | GO term name | Occurrences in ID list | FDR |
| 1 | GO:0042168 | heme metabolic process | 14 | 7.54E-28 |
| 2 | GO:0006778 | porphyrin-containing compound metabolic process | 14 | 2.51E-27 |
| 3 | GO:0033013 | tetrapyrrole metabolic process | 14 | 1.38E-26 |
| 4 | GO:0042440 | pigment metabolic process | 14 | 2.31E-25 |
| 5 | GO:0046501 | protoporphyrinogen IX metabolic process | 9 | 1.18E-19 |
| 6 | GO:0006783 | heme biosynthetic process | 10 | 1.34E-19 |
| 7 | GO:0033014 | tetrapyrrole biosynthetic process | 10 | 2.78E-19 |
| 8 | GO:0006779 | porphyrin-containing compound biosynthetic process | 10 | 3.18E-19 |
| 9 | GO:0006782 | protoporphyrinogen IX biosynthetic process | 8 | 1.67E-17 |
| 10 | GO:0046148 | pigment biosynthetic process | 10 | 2.34E-17 |
-
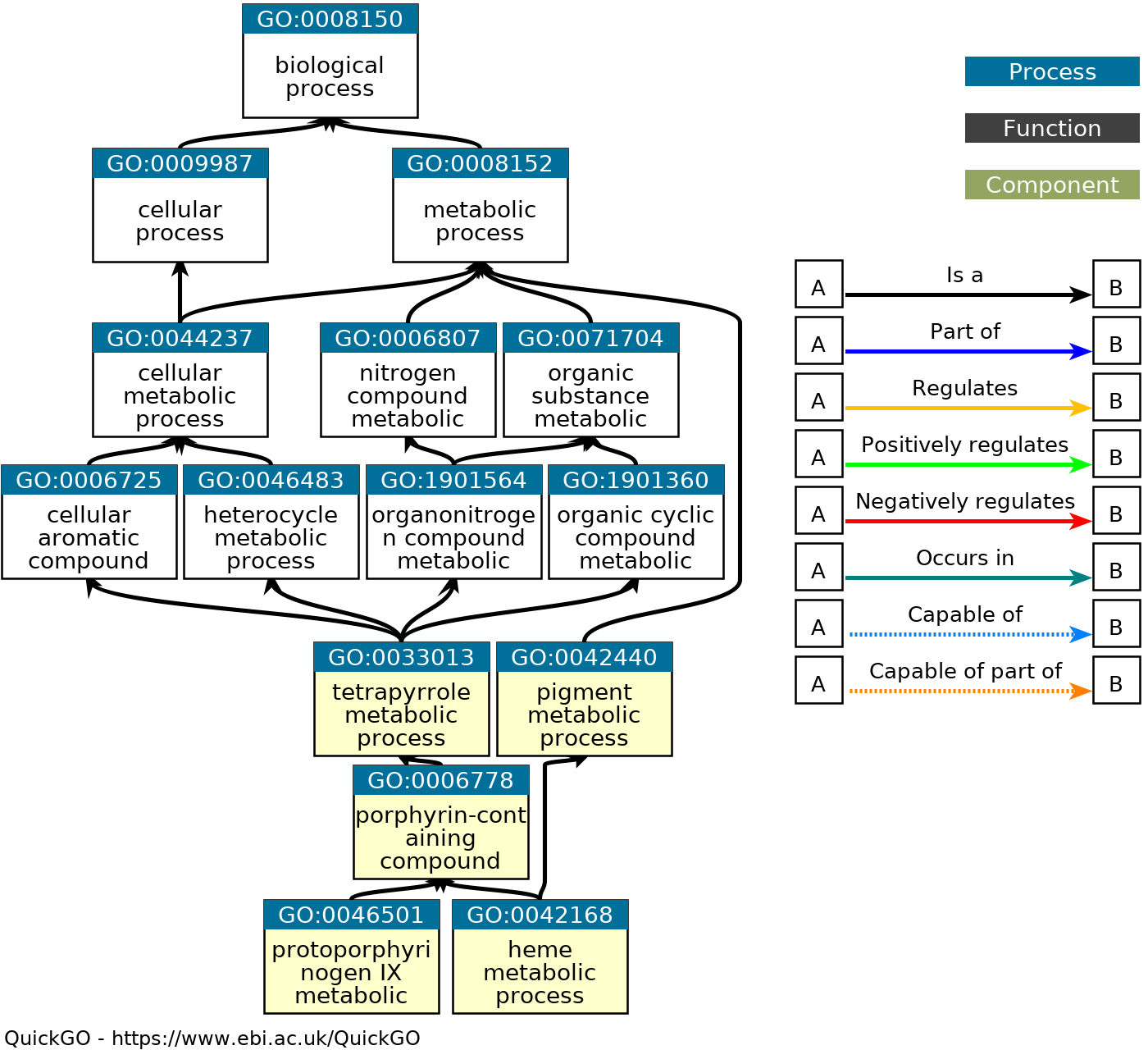
Граф QuickGO для 5 наиболее значимых найденных GO категорий:
-
Все узлы полученного графа соединены соотношениями типа "is a", то есть
узлы более высокого уровня в любом выбранном на графе пути кодируют
процессы, обобщающие процессы, кодируемые узлами более низкого уровня.
2 выбранные GO категории представляют самые глубокие узлы графа, остальные 3
выбранные GO категории кодируют более общие процессы. Отсюда можно сделать
вывод, что эти 2 выбранные категории (метаболизм гема и метаболизм
протопорфириногена IX) наиболее точно описывают процессы, частично
характеризующие набор белков с данными ID; с другой стороны, не исключено, что
некоторые из данных белков выполняют функцию, являющуюся частью (соотношение
типа "part of") метаболизма гема или более общего процесса
(например, метаболизма порфирин-содержащих веществ), но категория, кодирующая
их более специализированный процесс (например, гомеостаз ионов железа),
не была включена в топ-5 по FDR.
-
Большинство белков из списка ID об'единено тем или иным участием в метаболизме
гема. Лучше всего охарактеризовать этот список можно достоверными
GO категориями, с одной стороны, характеризующими наибольшее число белков
списка, а с другой стороны, описывающими наиболее разные процессы:
метаболизм гема (GO:0042168),
метаболизм протопорфирина IX (GO:0046501),
гомеостаз ионов железа (GO:0055072).
|
String
-
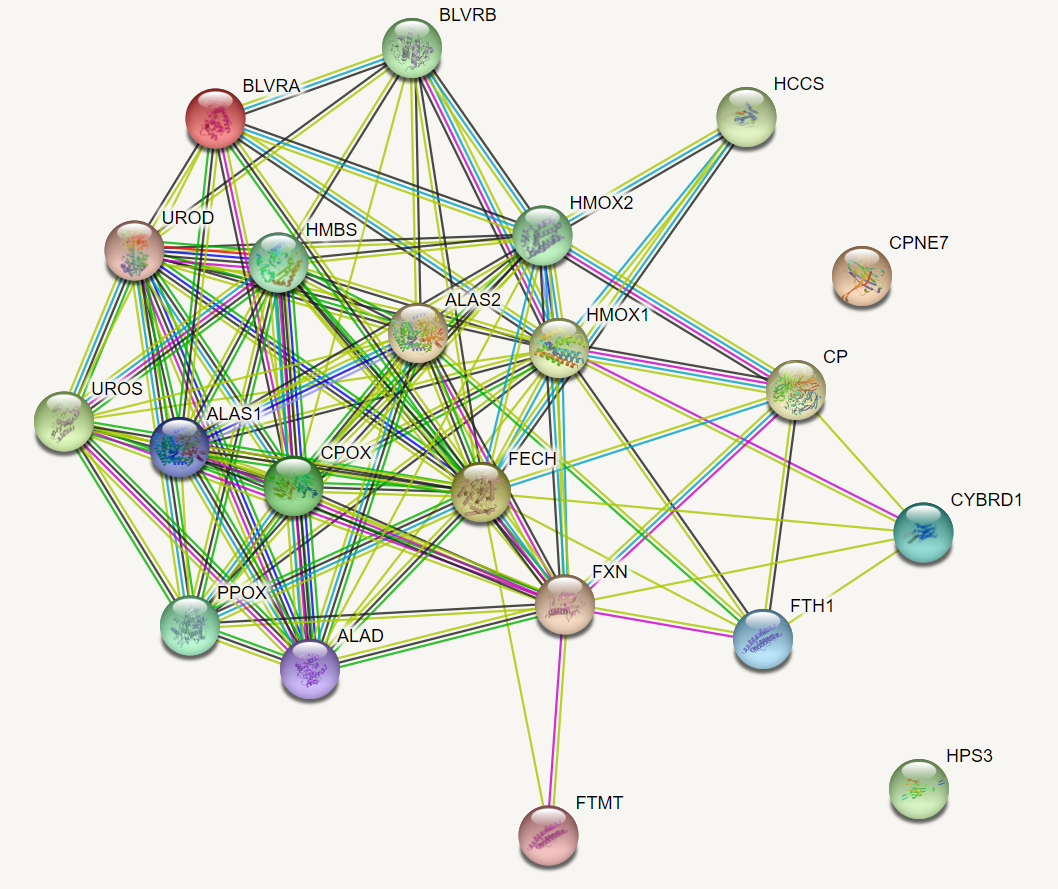
Граф, отображающий взаимодействия между 21 белком набора (интерпретация
одного ID как орексина была не включёна в анализ, ибо этот белок явно
функционально не кластеризуется с большинством остальных белков набора):
-
Для всех 21 белков (узлов графа) указано наличие 3D структуры.
-
На графе представлены все возможные взаимодействия узлов (приведены
ниже):
Можно наблюдать, что каждый белок набора, кроме CPNE7 и HPS3, имеет хотя бы
одно взаимодействие из группы "Known Interactions" с каким-нибудь
другим белком этого набора. Значительное число рёбер графа представлено
свидетельством о взаимодействии через нахождение упоминания об обоих белках
ребра в абстракте какой-либо статьи (самое ненадёжное свидетельство,
"Textmining").
Для белков UROD (уропорфириноген декарбоксилаза) и HMBS (порфобилиноген
деаминаза) наличествует свидетельство об их слиянии с одинаковым доменным
порядком (N-UROD-HMBS-C) у 3 неродственных групп эукариот:
Apusomonadida, Blastocladiomycota и Choanoflagellata.
Двое уже упомянутых белков CPNE7 (копин-7) и HPS3 (белок синдрома Германски
—Пудлака формы 3) никак не связаны на графе ни друг с другом, ни с
какими-либо другими белками набора. Дальнейшее расширение графа не нарушает
их обособленность (приведена седьмая итерация поиска связей):
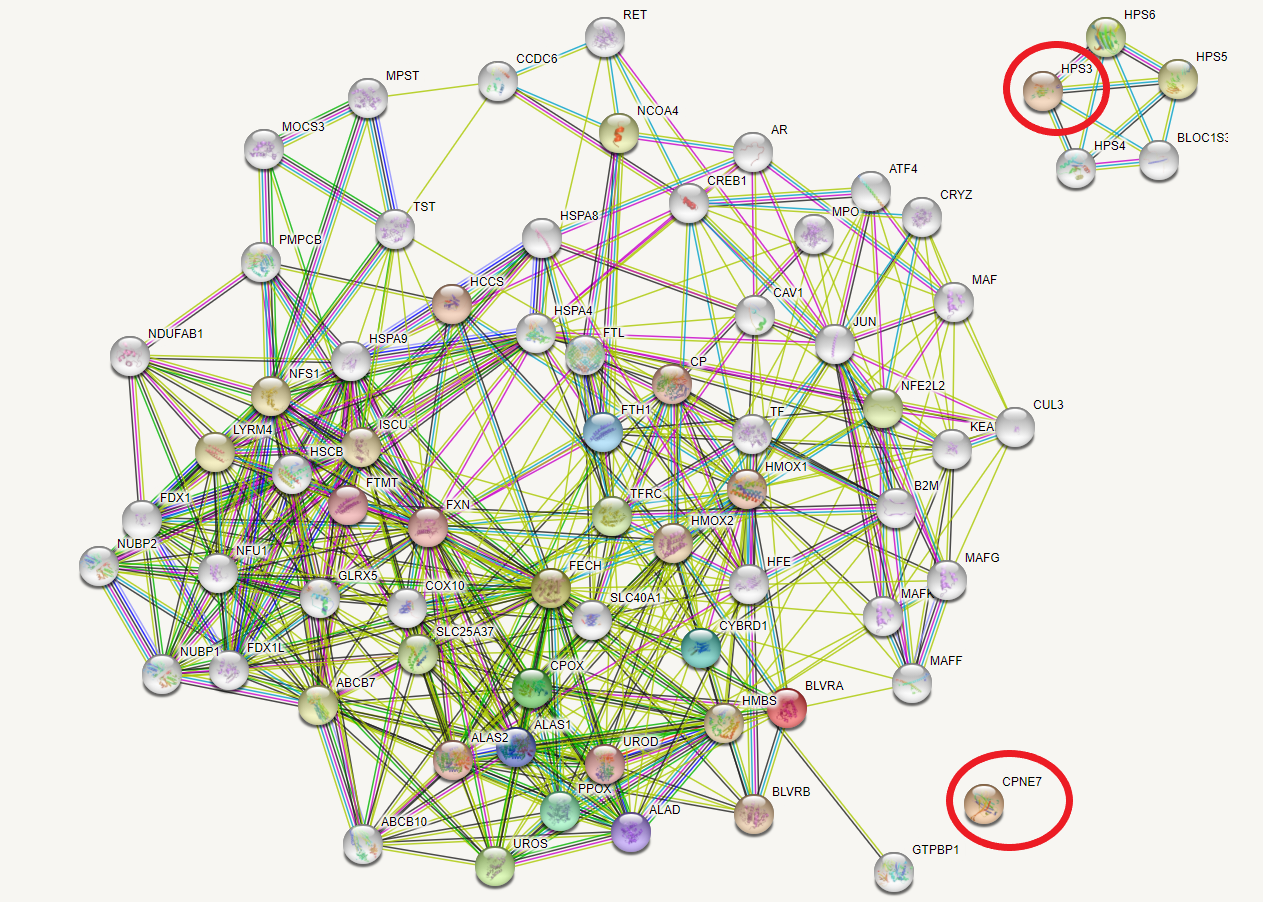
Копины имеют Ca2+-зависимую способность связываться с
фосфолипидами, возможно, рекруитируют таргетные белки к клеточным мембранам.
HSP3 связан с ранним биогенезом и созреванием меланосом. Эти функции,
дейтвительно, представляются не связанными как друг с другом, так и с
метаболизмом железа и порфиринов.
-
Паттерн распределения генов данного набора по древу жизни:
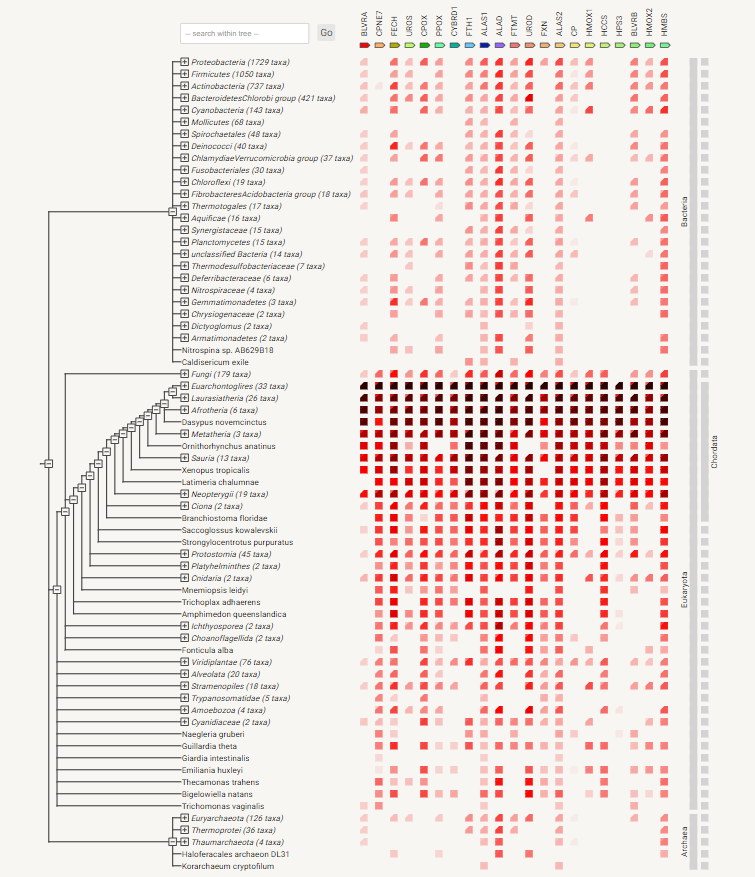
Для многих белков набора находятся гомологи как среди бактерий, так и
среди неэукариотических архей, хотя достоверность большинства из этих
находок сомнительна. Достоверность находок становится хорошей, начиная с клады
Opisthokonta. Гомологи белков CPNE7, CYBRD1 и HCCS встречаются только у
эукариот, гомологи митохондриального ядерно кодируемого белка FXN встечаются
у многих эукариот, а также, видимо, у протеобактерий — предков
митохондрий. Достоверные гомологи HPS3 встречаются только у животных.
Полный набор этих белков не полностью консервативен даже у млекопитающих.
-
Паттерны коэкспрессии генов набора на основе данных РНК экспрессии и
белковой корегуляции для человека и для об'единения всех клеточных организмов,
по которым имееются данные:
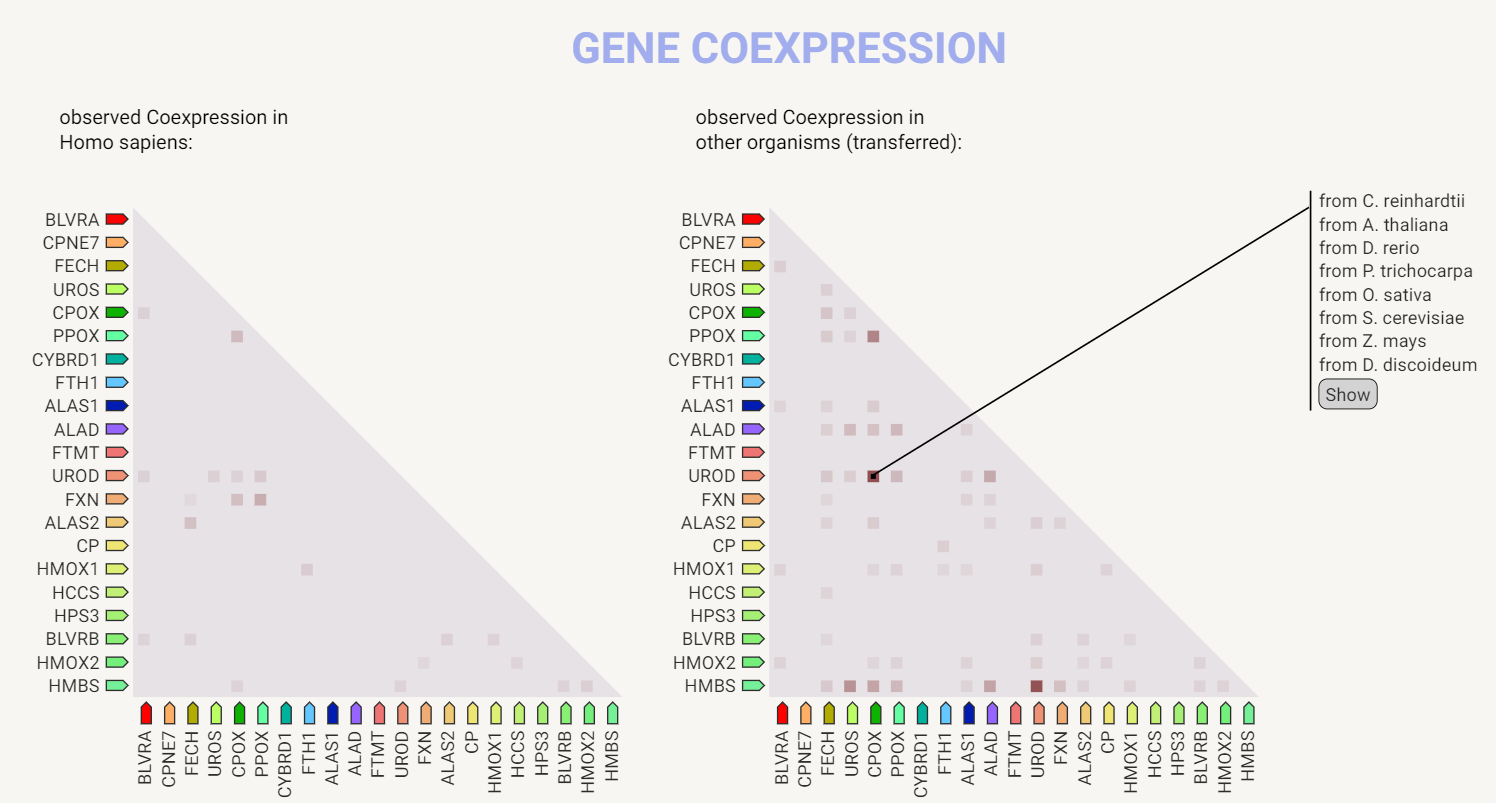
Учитывая определённую выше функциональную связанность белков набора, можно
было бы ожидать больший уровень коэкспрессии генов этих белков у человека.
У человека наибольшая коэкспрессия наблюдается для пар генов PPOX и UROD,
PPOX и FXN, PPOX и CPOX, FECH и ALAS2, CPOX и FXN. Общий паттерн экспрессии
для других организмов, как и ожидалось, более разнообразный. Интересно
отсутствие коэкспрессии пары UROD и HMBS у человека, хотя она присутствует у
широкого спектра эукариот, включая грызунов, и у нескольких бактерий.
|
Human Protein Atlas
-
Для обзора экспрессии и функций в организме человека был выбран ген ALAS1.
-
Ядерный ген ALAS1 (расположение 3p21.2) кодирует митохондриальный фермент
5'-аминолевулинат синтазу 1, катализирующий самый медленный этап в биосинтезе
гема. Фермент, кодируемый этим геном, является housekeeping-ферментом;
отдельный ген кодирует форму этого фермента, специфичную для эритроцитов и
их предшественников. Уровень зрелого белка регулируется гемом: высокий уровень
гема даунрегулирует зрелый белок в митохондриях, тогда как низкий уровень
гема — апрегулирует. Псевдоген этого гена расположен на хромосоме 12.
Альтернативный сплайсинг гена создаёт множество вариантов транскриптов,
кодирующих разные изоформы.
-
Ген ALAS1 имеет невысокий общий уровень экспрессии в мозге и не обладает
региональной специфичностью для какого-либо участка мозга:
-
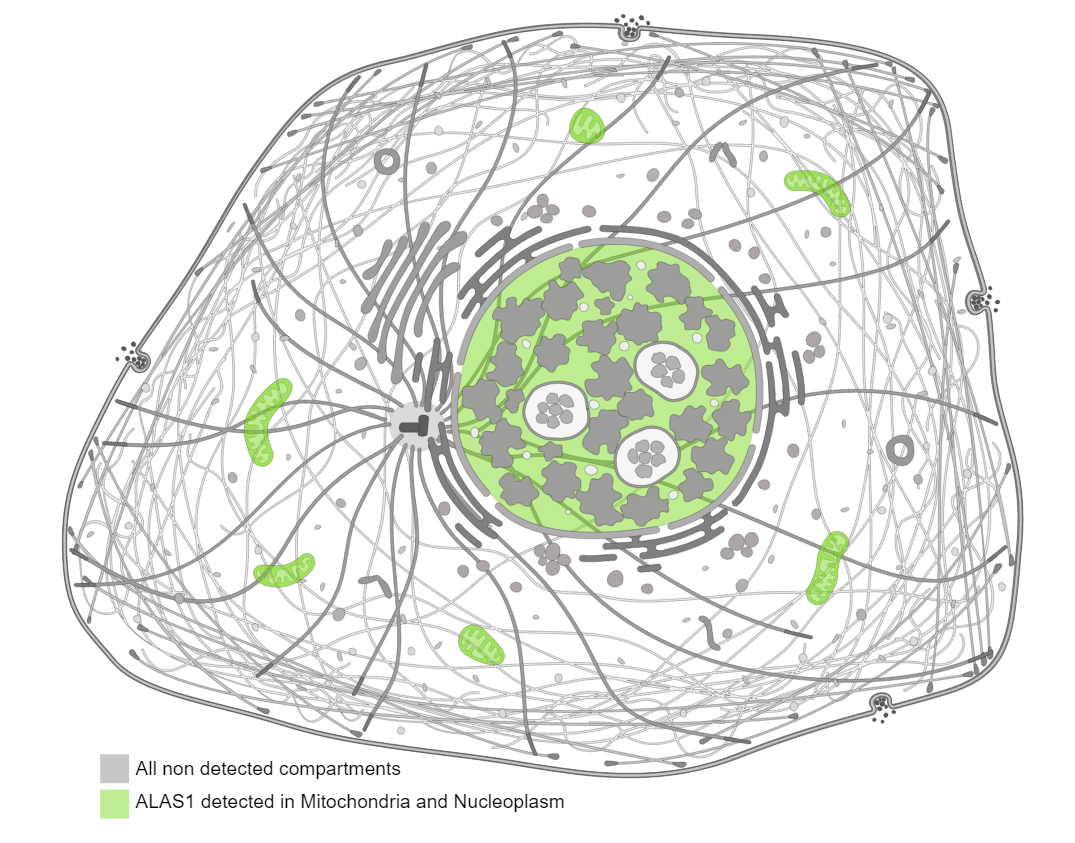
Белок гена ALAS1 локализуется, в основном, в митохондриях, но также
содержится и в нуклеоплазме:
-
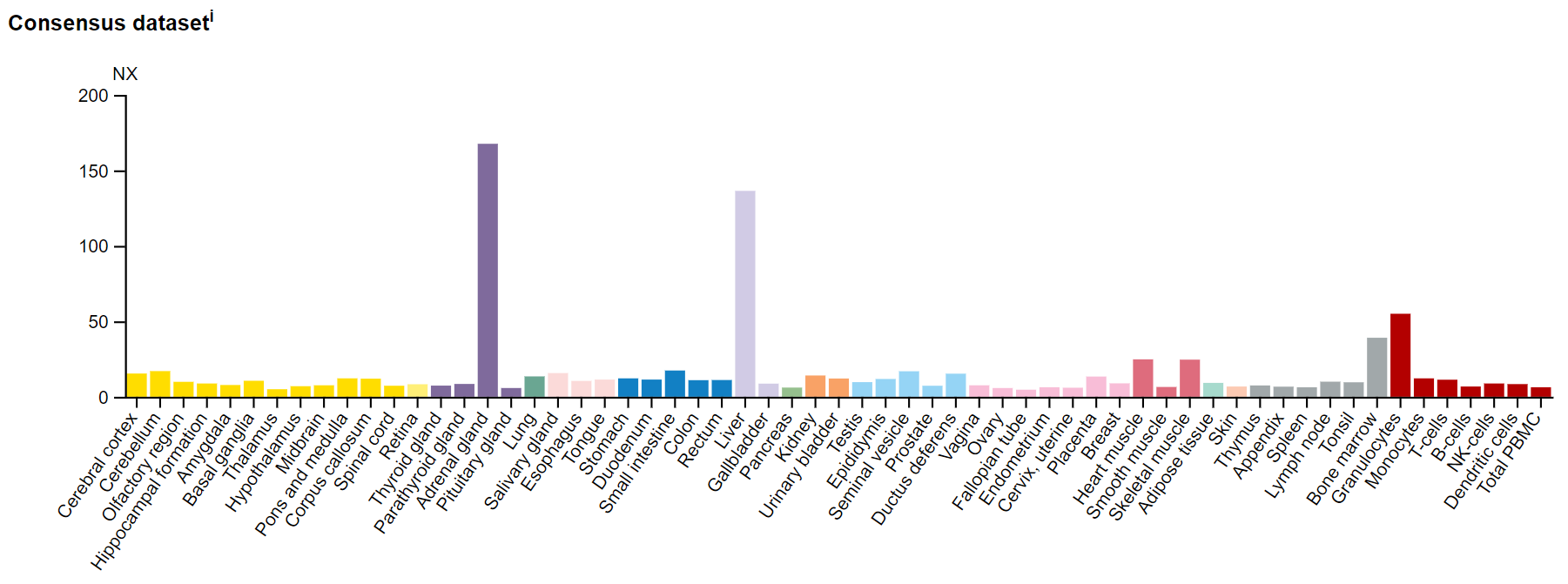
Значительные уровни мРНК гена ALAS1 наблюдаются только в надпочечниках и
печени, однако уровни белкового продукта этого гена довольно высокие во всех
тканях, кроме глаз и крови:
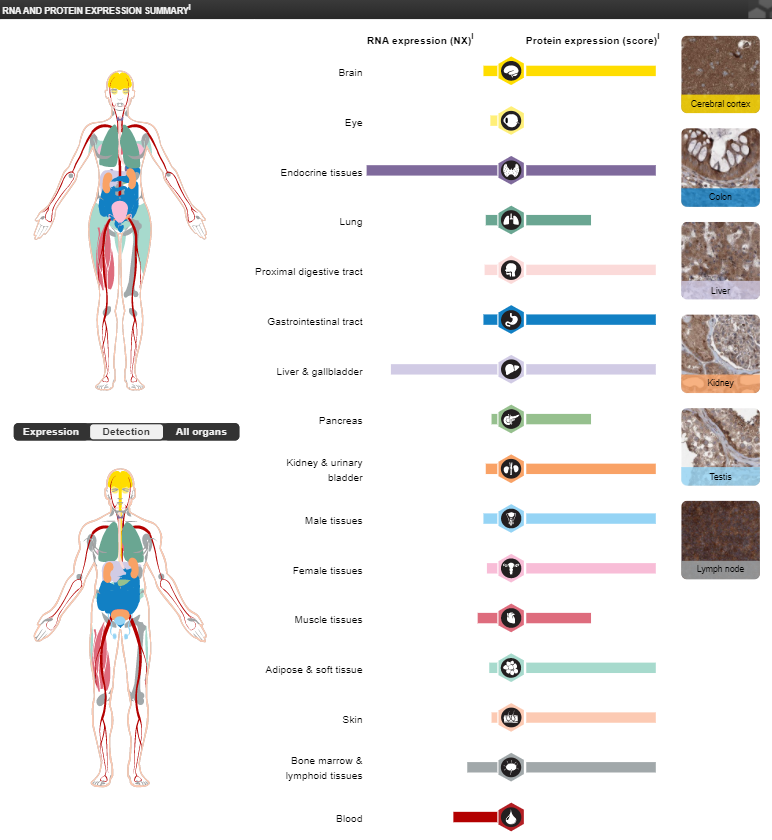
-
РНК продукты гена ALAS1 присутствуют во всех тканях, но экспрессия особенно
высока в тканях надпочечников и печени:
|
|
|