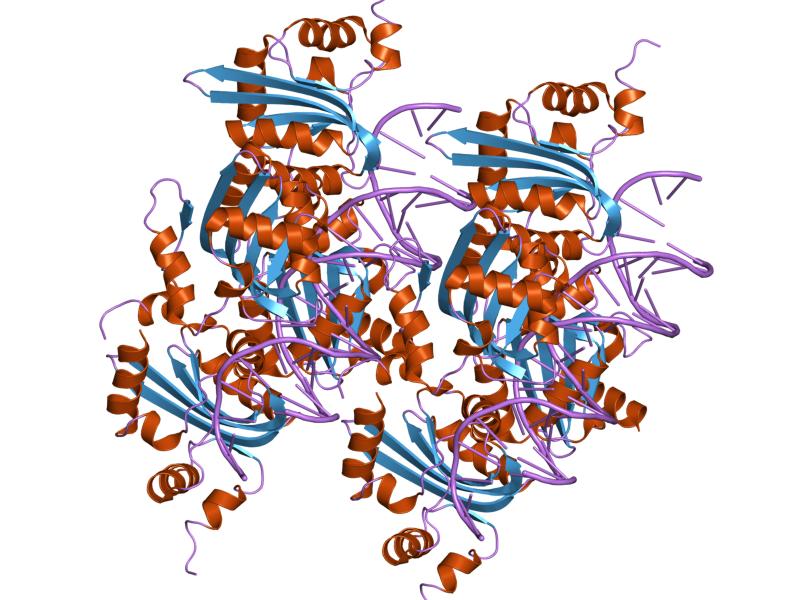
- молекулы ДНК (с цепями C, G, K, O)
- молекулы репликационного белка Е1 (АТФ-зависимой хеликазы Е1) (с цепями A, B, E, F, I, J, M, N).
В силу симметричности комплекса, для исследования была выбрана лишь одна его часть, а именно: цепи A, B, E, F белка и цепи C, G , представляющие ДНК со следующей последовательностью:
цепь C [1] 5' - ataattgttgttaacaacaat - 3' [21]
||||||||||||||||||
цепь G [21] 3' - taacaacaattgttgttaata - 5'[1],
где 1 и 21 - номера первого и последнего нуклеотида.
Исходя из полученных данных, можно заключить о достаточно сильной деформации молекулы ДНК в местах связывания с белком. Возможно, это происходит из-за того, что ДНК стремится принять наиболее энергетически выгодное положение для образования комплекса с белком.
В скрипте my_dna.def приведены команды для выделения в RasMol множеств, необходимых для определения числа контактов.
Контакты разного типа в комплексе 1KSX.pdb
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 2 | 40 | 42 |
| остатками фосфорной кислоты | 35 | 44 | 79 |
| остатками азотистых оснований со стороны большой бороздки | 0 | 24 | 24 |
| остатками азотистых оснований со стороны малой бороздки | 0 | 0 | 0 |
Как известно, множество остатков фосфорной кислоты расположено на внешней стороне ДНК, а значит, легко доступно для образования контактов с атомами белка. По этой причине было обнаружено программой Rasmol 79 контактов с остатками фосфорной кислоты. Также было найдено 42 (что меньше, нежели 79) контакта белка с атомами дезоксирибозы. И ведь действительно, атомы сахара располагаются по бокам молекулы ДНК, однако, находятся чуть дальше от самого белка, за рядом атомов остатков фосфорной кислоты.
Что же касается взаимодействия белка с атомами большой и малой бороздок ДНК, то относительно много контактов (24, неполярных) было обнаружено со стороны большой бороздки, в то время как не было обнаржено ни одного контакта с остатками азотистых оснований со стороны малой бороздки. Объясняется это, вероятно, тем, что бороздка довольно глубокая, а значит, возможность проникновения внутрь нее атомов белка выше, т.е. вероятность распознавания в данной области увеличивается.
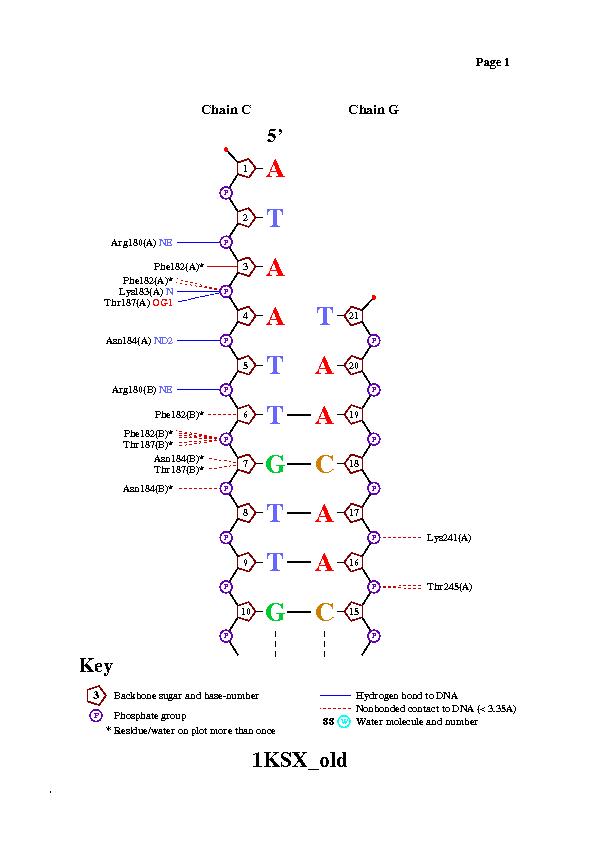
Сравнивая представленную выше схему с результатами из п.III, заключаем, что область "искривления" напрямую не зависит от зоны контактов с белком.
Примечательно, что данные о контактах, полученные посредством программы RasMol и выдачей nucplot, различаются. В количественном плане RasMol превзошел nuclplot в разы. Nuclplot обнаружил контакты между белком и остатками 2'-дезоксирибозы, а также с остатками фосфорной кислоты, пусть и в меньшем количестве, нежели RasMol. Что же касается выдачи результатов о контактах белка с остатками азотистых оснований со стороны большой бороздки, ни об одном таком контакте nuclplot заявлено не было, в отличие от RasMol (найдено 24 контакта).
Возможно, данные различия обусловлены отличающимися подходами к распознаванию ДНК-белковых взаимодействий: во-первых, в программе RasMol мы искали контакты между отдельными атомами, в то время как nuclplot ищет взаимодействия между основаниями ДНК, остатками 2'-дезоксирибозы и фосфорной кислоты и аминокислотами в целом, во-вторых, может различаться определяющий критерий расстояния для идентификации потенциальных контактов.
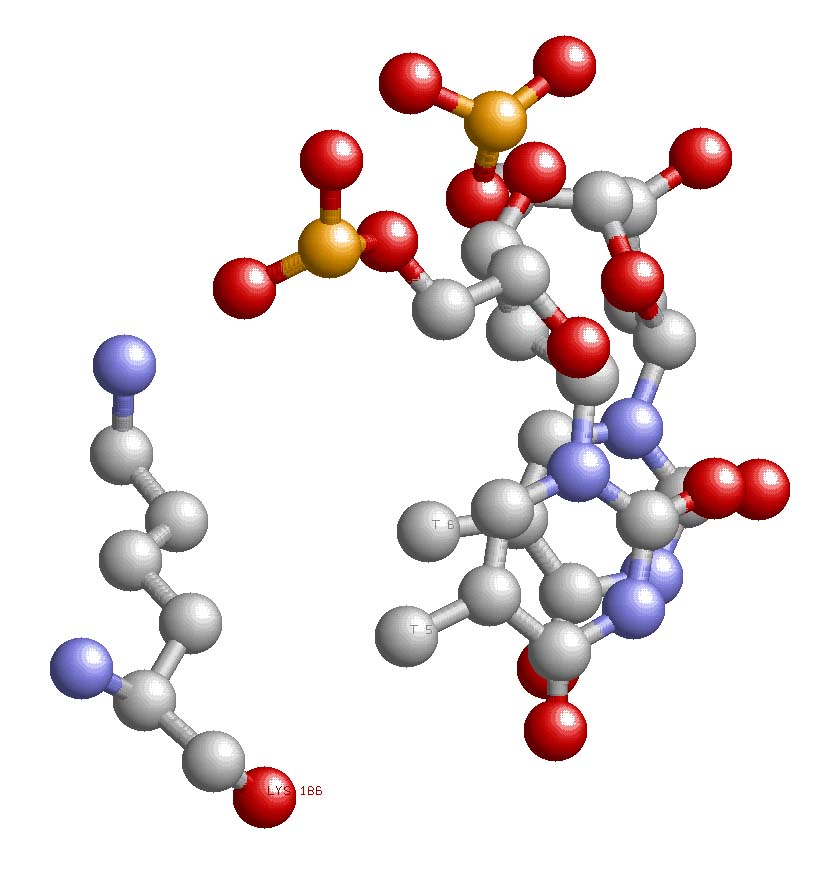 |
В качестве искомого контакта было выбрано взаимодействие LYS186 с T5 и T6. Выбор был таковым по трем причинам: во-первых, это взаимодействие между аминокислотой и азотистыми основаниями, что является главной определяющий при выборе распознающего контакта, во-вторых, в данном "трио" лизин взаимодействует аж с двумя тиминами, что, несомненно, увеличивает вероятность существования данного контакта, и в-третьих, данное взаимодействие находится в области существования наибольшего количества ДНК-белковых взаимодействий. |

В моем белке ДНК-связывающим доменом является PPV_E1_C.
Описание ДНК-хеликазы Е1 Папилломавируса, С-концевого участка.
Папилломавирусы - большое семейство онкогенных ДНК-содержащих вирусов, которые вызывают образование бородавок и папиллом на теле хозяина. Белок Е1 является АТФ-зависимой хеликазой, необходимой для инициации репликации вирусной ДНК. Она образует комплекс с вирусным белком Е2, который является сайт-специфическим ДНК-связывающим активатором транскрипци. Е1-Е2 комплекс связывается с точкой инициации репликации, который содержит сайты связывания для обоих белков.
Белок Е1 - 70 кДа полипептид с центральным ДНК-связывающим доменом и С-концевым АТФ-связывающим и хеликазным доменом. Он взаимодействует специфически с 18-нуклеотидной последовательностью ДНК в области инициации репликации, расплавляет ДНК-дуплекс и работает как 3'-5' хеликаза. Кроме белка Е2 она также взаимодействует с ДНК-полимеразой альфа и репликативным А-белком. ДНК-связывающий домен образует антипараллельный 5-цепочечный бета-лист, контактирующий по краям с одной стороны с 4мя свободно упакованными альфа-спиралями и с другой - 2мя плотно упакованными спиралями. Два структурных модуля внутри этого домена, как растянутая петля и спираль содержат консервативные аминокислотные остатки, критические для связывания ДНК. В растворе белок Е1 является мономером, но связывает ДНК как димер. Два Е1 белка формируют димер при связывании с ДНК, что приводит к ее плавлению в точке инициации репликации и ведет к формированию гексамера из Е1-белков с хеликазной активностью.