Белок и «лиганд»
Лиганд — это молекула, связанная с белком, которая довольно часто участвует в формировании структуры этого белка или в его функционировании. Центр связывания (участок белка, где происходит взаимодействие с лигандом) обычно имеет вид углубления на поверхности белковой молекулы. Это углубление образует лишь часть аминокислот, остальные участвуют в поддержании формы белка и создании дополнительных центров связывания.
Для наилучшего взаимодействия лиганда с белком между ними должно одновременно образовываться множество слабых свзей. Именно поэтому к белку присоединяются только в точности подходящие к его поверхности лиганды[1].
В PDB-файле, содержащем исходный белок, дегидратазу, на примере которого началось изучение трёхмерных структур и рассматривались внутримолекулярные взаимодействий в белковой молекуле, в качестве лигандов было несколько сульфат-ион. Но, увы, взаимодействия данных лигандов с белком оказались не особо интересными. Также было непонятно их значение в регуляции работы белка из-за отсутствия отдельной статьи про этот белок. Поэтому для изучения взаимодействия лиганда с белком было решено взять хоминг-эндонуклеазу I-GzeII (Рисунок 1).
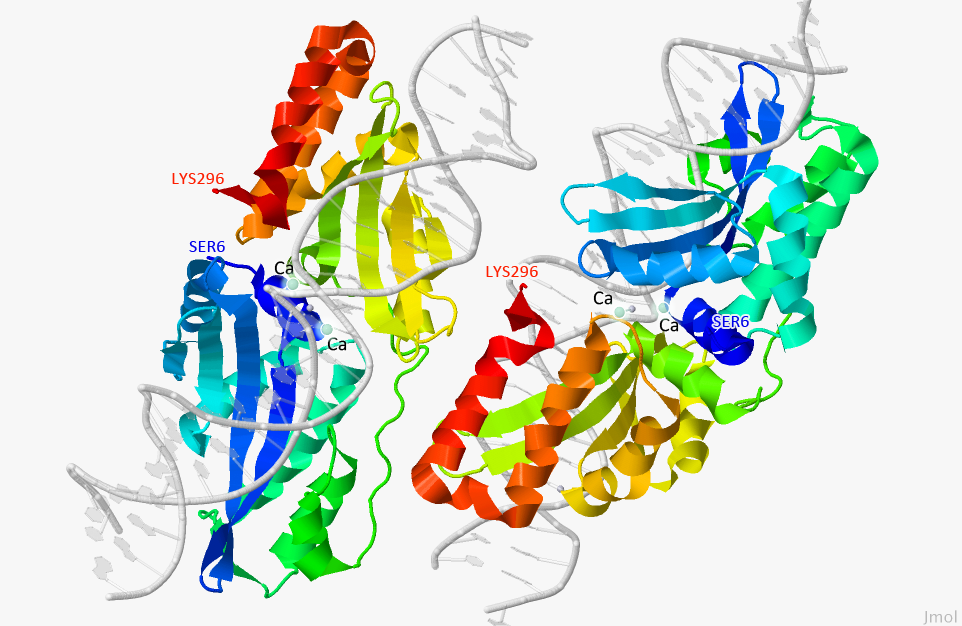
Рисунок 1. Пространственное строение хоминг-эндонуклеазы I-GzeII с сайт-мишенью ДНК и лигандами.
На рисунке подписаны начало и конец белка (SER6 и LYS296 соответственно), лиганды (Ca). Белым цветом окрашена структура ДНК, серым цветом обозначены молекулы воды, которые предположительно входят в активный сайт белка. При наведении курсора появляется только структура белка и лиганды.
Для того, чтобы получить такое же изображение, можно воспользоваться данным скриптом.
Рисунок получен с помощью программы Jmol.
Ниже представлено небольшое описание хоминг-эндонуклеаз и их типичного активного сайта. Вся эта информация была нужна, чтобы лучше разобраться с тем, как лигандом взаимодействует с белковой молекулой и каково его значение.
Также можно сразу перейти к описанию области контакта белка и лиганда.
Хоминг-эндонуклеаза I-GzeII
Хоминг — это процесс, в результате которого происходит однонаправленный перенос копии последовательности ДНК интрона из гена, который содержит эту последовательность, к аллельному гену, не содержащему её[2].
Эндонуклеаза, кодируемая рамкой открытого считывания инторона I или II группы, катализирует эндонуклеазный разрыв обеих цепей ДНК в безинтеиновой аллели. Далее происходит репарация двуцепочечного разрыва с помощью гомологичной рекомбинации. Таким образом, последовательность интрона включается в состав гена. Процесс хоуминга интрона изображен на Рисунке 2.
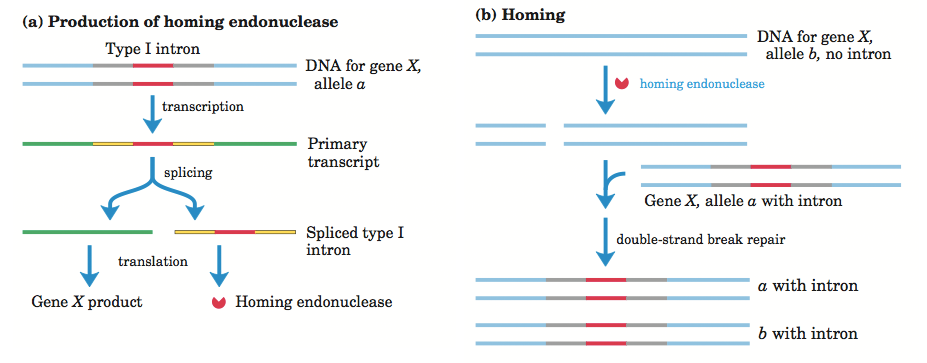
Рисунок 2. Образование хоминг-эндонуклеазы и процесс хоминга.
Фиолетовым цветом обозначена цепочка, соответствующая дегидратазе, зелёным — белка rv0216. Голубым отмечен участок расхождения, белым цветом выделены Cα-атомы совпадающих одинаковых аминокислотных остатков.
Изображение взято из учебника Lehninger Principles of Biochemistry 2004, Fourth Edition, стр. 1025.
Также существует интеин-хоминг, чей механизм абсолютно аналогичен описанному выше[3], и соответственно катализирующие его эндонуклеазы.
Нуклеазы, инициирующие хоминг, называются хоминг-эндонуклеазами. Их особенность состоит в том, что, несмотря на свой относительно небольшой размер, они распознают довольно длинные последовательности ДНК (12-40bp), в отличии от эндонуклеаз рестрикции, у которых короткая распознавательная последовательность (4-8bp)[4].
Хоминг-эндонуклеаза встречается во всех трёх биологических доменах: археях, бактериях, эукариотах, — и экспрессируется, как в ядре, так и митохондриях и хлоропластах[4].
На основе наличия особых структурных мотивов в аминокислотных последовательностях данных эндонуклеаз выделяют следующие структурные семейства[4]:
- LAGLIDADG
- GIY-YIG
- His-Cys box
- H-N-H
- PD-(D/E)xK
- Vsr-like
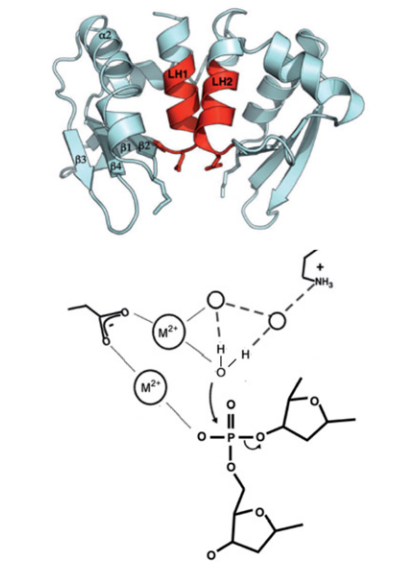
Изображения взято из этой статьи.
Изучаемый мной белок I-GzeII относится к семейству LAGLIDADG, для которого характерна αββαββα структура ядра, а также двувалентный металл, в качестве кофактора[5]. Нуклеазы этого семейства распознают длинные псевдопалиндромные последовательности ДНК[2].
LAGLIDADG-белки используют два иона металла для гидролиза ДНК-последовательности. Один из ионов даёт гидроксид-комплекс и выступает в качестве нуклеофила, то есть предоставляет электронную пару. Второй связанный металл-ион стабилизирует фосфо-анион и 3'-уходящую группу[6].
Активный сайт белков этого семейства — нуклеофильная, связанная с металлом, вода, которая не координирована напрямую боковыми цепями белка, а окружена сетью упорядоченных дополнительных молекул растворителя. Довольно часто два активных сайта, которые расположены бок о бок, обладают общим ионом металла[6]. Изображение характерного активного сайта показано на Рисунке 3.
Номенклатура хоминг-эндонуклеаз аналогична номенклатуре ферментов рестрикции[5]. Приставка "I-" означает, что это интронная эндонуклеаза. Далее, "Gze" — сокращение родового и видового названия — Gibberella zeae — организма, откуда был получен данный белок. "II" говорит о том, что это уже вторая подобная структура, найденная в этом организме.
[1] Молекулярная биология клетки: В 3-х томах. Том 1. Стр. 155-157
Авторы: Б.Албертс, Д.Брей, Дж.Льюис, М.Рэфф, К.Робертc, Дж.Уотсон.
2-е издание, переработанное и дополненное.
Москва: Издательство 'Мир'. Редакция литературы по биологии, 1994
[2] Homing endonucleases: structure, function and evolution.
Jurica MS, Stoddard BL.
Cell Mol Life Sci. 1999 Aug 15;55(10):1304-26. Review.
PMID: 10487208 [PubMed - indexed for MEDLINE]
[3] http://humbio.ru/humbio/genexp/001158b6.htm
[4] http://en.wikipedia.org/wiki/Homing_endonuclease
[5] http://books.google.ru/books?id=cHB1LECHjzsC
[6] Homing endonucleases from mobile group I introns: discovery to genome engineering
Barry L Stoddard
Описание области контакта c лигандом (ион кальция) в структуре белка I-GzeII (идентификатор PDB 4EFJ)
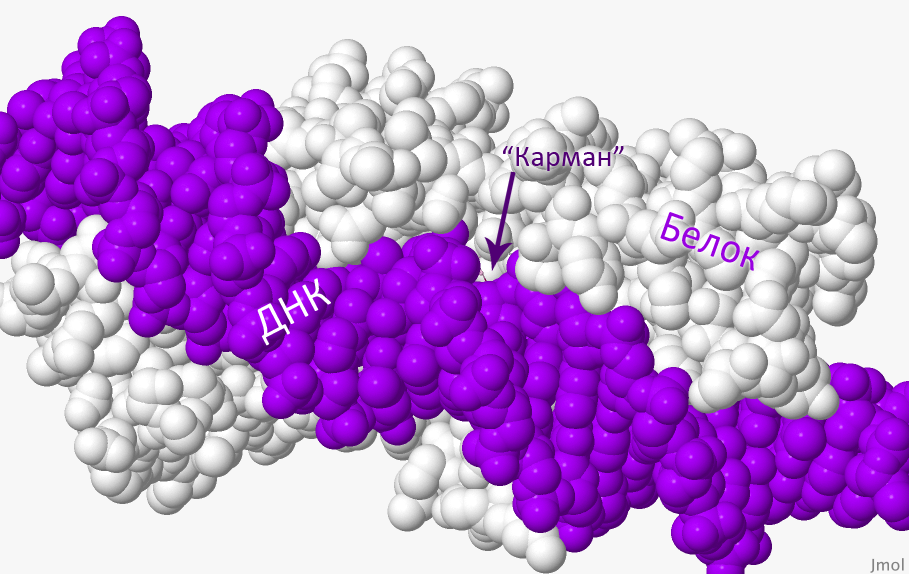
Рисунок 4. Взаимодействие лиганда и белка. На рисунке белым цветом обозначен белок (цепь B), фиолетовым — ДНК (цепи F и E). При наведении курсора появляются два лиганд и находящиеся от них на расстоянии меньше 4 Å аминокислотные остатки, а также молекула воды.
Рисунок получен с помощью программы J-mol.
В PDB-файле белка I-GzeII содержится, помимо молекул воды, четыре лиганда. Все они являются ионами двухвалентного металла — ионами кальция. Исходя из статей про белки из данного семейства, этот лиганд является кофактором для данной хоминг-эндонуклезы[5].
В Таблице 1 приведено название лиганда на русском, английском языках, как он обозначается в PDB-файле, а также его формула. На Рисунке 4 виден карман, который образует поверхность белковой молекулы, молекула ДНК и сами лиганды. На Рисунке 1 можно увидеть изображение белка целиком, а также всех лигандов.
| Графа | Значение |
| Формула | Ca2+ |
| Русское название | Ион кальция |
| Английское название | Calcium ion |
| Название в файле PDB | CA |
Так как цепочки белка симметричны, рассмотрим одну из них — цепь B, а вместе с тем и лиганды, взаимодействующие с ней. На Рисунке 5 изображены 2 кальция, взаимодействующие с белком. Jmol-скрипт, создающий аналогичное изображение, можно скачать отсюда.
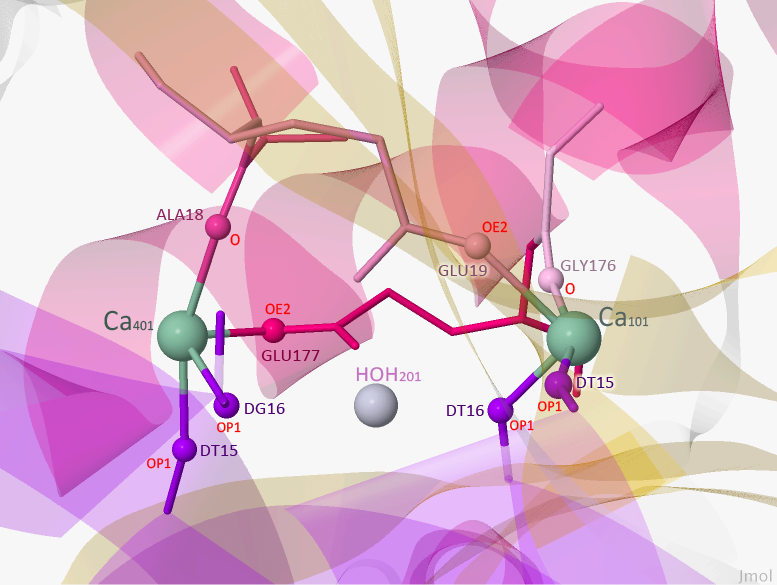
Рисунок 5. Лиганды, контактирующие с цепью B данного белка.
Красным цветом подписаны электроотрицательные атомы.
Рисунок получен с помощью программы J-mol.
Исходя из pdb-файла, активный сайт, с которым взаимодействует Ca401, состоит из двух аминокислотных остатков (аланина и глутаминовой кислоты) и двух фосфатов (DT и DG). Более подробное изображение взаимодействия кальция с белком представлено на Рисунке 6.
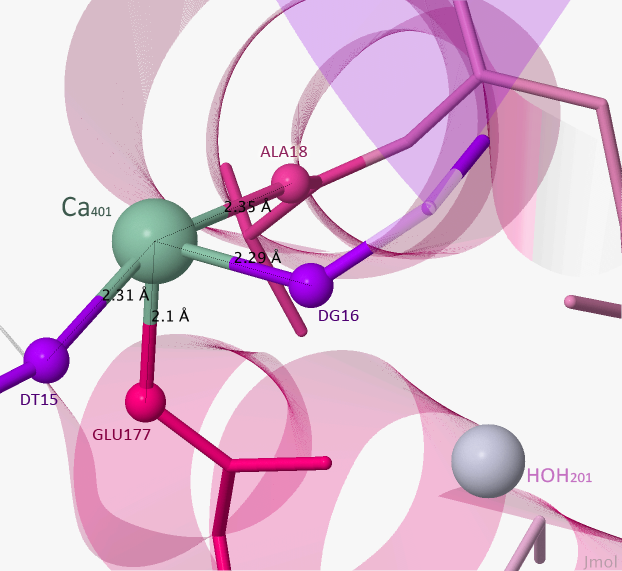
Рисунок 6.Зона контакта Ca401 с белком.
Пунктирными линиями отмечены связи лиганда с белком.
Рисунок и измерения получены с помощью программы J-mol.
Из Рисунка 6 видно, что кальций связан с фосфатами и двумя аминокислотными остатками. Длины связей не превышают 3 Å. Вода находится слишком далеко, поэтому никак не взаимодействует с лигандом.
Теперь рассмотрим второй ион металла — Ca101. Основываясь на pdb-файл и использованный мной скрипт, данный лиганд взаимодействует с глутаминовой кислотой, глицином и двумя фосфатами (DT16 и DT15). На Рисунке 7 можно увидеть зону контакта лиганда с белком более подробно.
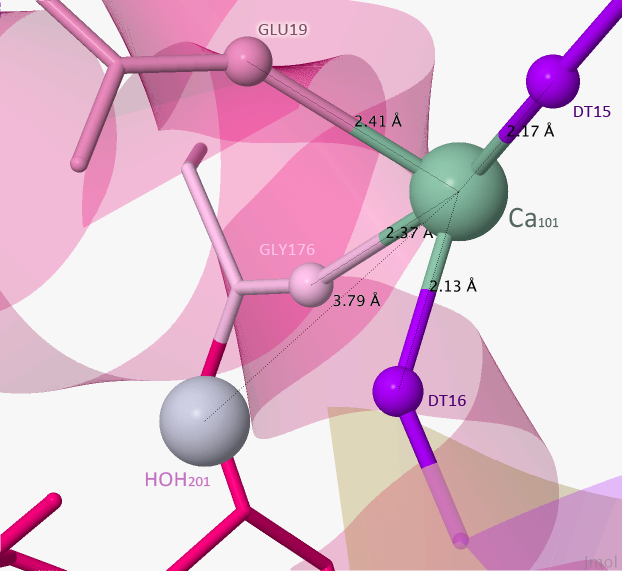
Рисунок 7.Зона контакта Ca101 с белком.
Пунктирными линиями отмечены связи лиганда с белком.
Рисунок и измерения получены с помощью программы J-mol.
Также мне показалось интересным рассмотреть ещё один кальций, Ca402, который взаимодействует с цепью А. Изображение зоны контакта данного лиганда можно увидеть на Рисунке 8.
Необычным показалось то, что данный лиганд связан с водой. к тому же, в pdb-файле прописано, что в активный сайт, с которым связывается данный белок, входит лизин (а именно положительно заряженный азот в боковой цепи). Вероятней всего этот аминокислотный остаток каким-то образом взаимодействует с растворителем, которого в данной трёхмерной структуре почти нет.
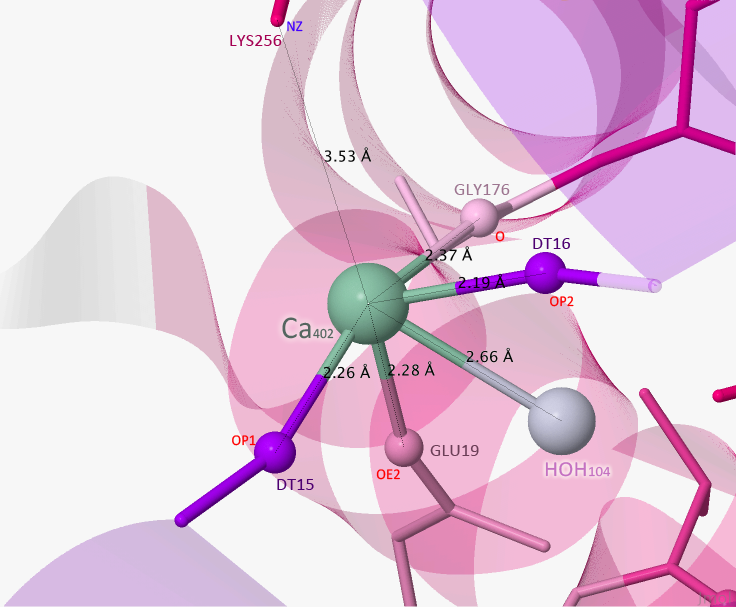
Рисунок 8.Зона контакта Ca402 с белком.
Пунктирными линиями отмечены связи лиганда с белком, красным цветом — отрицательно заряженные атомы, синим — положительно.
Рисунок и измерения получены с помощью программы J-mol.
Если говорить о роли данных лигандов, то, основываясь на статьи, упомянутые выше, это кофакторы белка, то есть они активно принимают участие в функционированнии белка. Также, если вновь обратиться к статьям про семейство данного белка, то можно заметить несколько отличий в активном сайте I-GreII по сравнению с остальными. Во-первых, металл почему-то напрямую связан с отрицательно заряженной глутаминовой кислотой, хотя связь (основываясь на статьи) должна осуществляться через молекулы воды. Во-вторых, оба кальция связаны с фосфатами, причём сразу с двумя. Возможно, эти отклонения возникли из-за того, что белок был закристаллизован вместе с участком ДНК. Также на конформацию белка мог повлиять и выбранный для эксперимента раствор.
Проект генно-инженерного эксперимента с белком I-GreII из структуры 4EFJ
В связывании лиганда довольно важную роль играет отрицательно заряженная глутаминовая кислота. Если попробовать её заменить на нейтральный глутамин, то белок вероятней всего не сможет больше нормально взаимодействовать с кальцием.
Если же глутаминовую кислоту заменить на аспарагиновую, то есть большая вероятность того, что это никак не повлияет на связывание лиганда с белком.