Сравнение водородных связей в структурах, расшифрованных с помощью ЯМР и РСА
Рассматривалась структура белка Erbin, которая была получена и методом РСА (PDB: 2H3L), и ЯМР (PDB: 1N7T). Разрешение РСА модели — 1 Å, количество моделей в ЯМР — 20. На рис. 1 представлен общий вид структур.
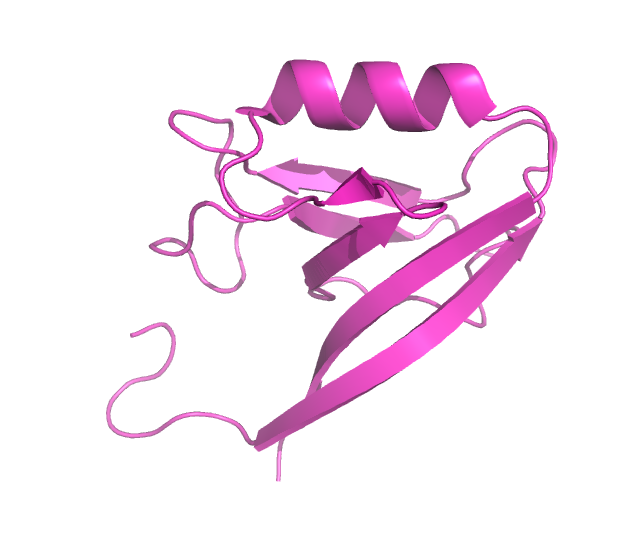
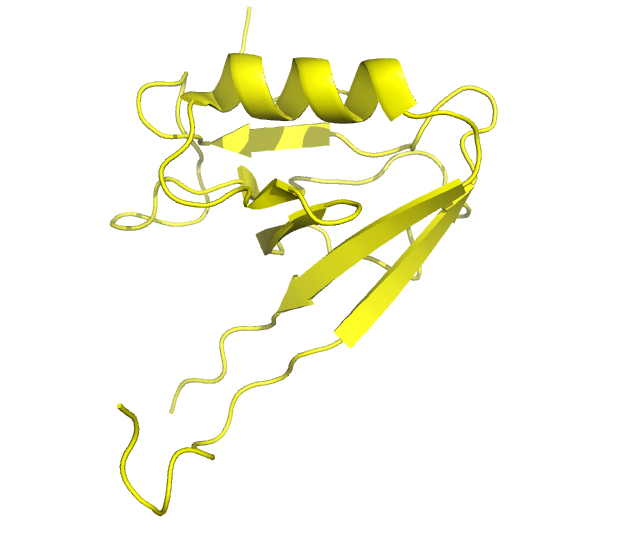
Рисунок 1. Общий вид структуры белка, расшифрованный с помощью РСА (слева) и ЯМР (справа).
Рисунок получен с помощью программы PyMOL.
На данных моделях изучали и сравнивали три водородные связи: в остове α-спирали, между петлёй и β-листом (внутри глобулы) и на поверхности β-листа. Водородные связи искались с помощью команды (distance hbond, name N*, name O*, 3.5, mode=2) или опции PyMOL (action -> find -> polar contacts).
Полученные данные были сведены в таблицу 1.
| Положение водородной связи | Донор | Акцептор | Длина связи в РСА | Процент моделей ЯМР | Среднее расстояние ЯМР (N-O) | Минимальное расстояние ЯМР (N-O) | Максимальное расстояние ЯМР (N-O) |
| Остов α-спирали | Ser1393 N | Gly1389 O |
2.8 | 100% (20/20) |
3.075 | 2.8 | 3.2 |
| Между петлёй и β-листом | Arg1408 NE | Asp1373 OD1* | 2.9 | 10% (2/20) |
3.2 | 3.1 | 3.3 |
| На поверхности β-листа | Arg1323 NH1 | Glu1403 OE1 | 2.9 | 15% (3/20) |
2.7 | 2.6 | 2.8 |
*в ЯМР связь была с OD2-атомом
На рис. 2-4 представлено графическое представление рассматриваемых водородных связей. Примечательно, что в случае с H-связью между петлёй и β-листом (рис. 3), в ЯМР структуре H-связь образовывалась исключительно с OD2-атомом аспартата, в отличае от РСА варианта.
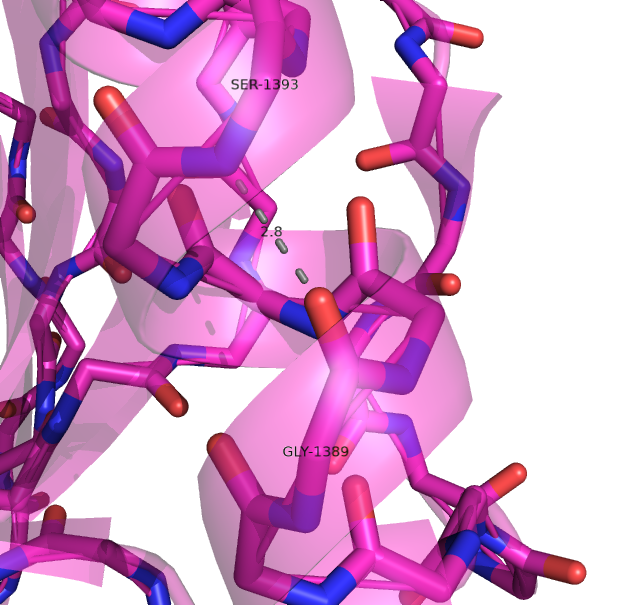
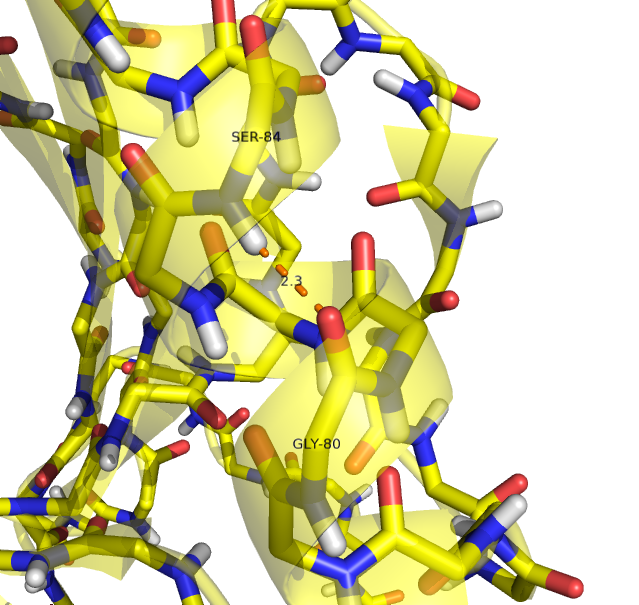
Рисунок 2. Водородные связи в остове α-спирали в структуре, расшифрованной с помощью РСА (слева) и ЯМР (справа).
Водородная связь показана прерывистой линией.
Рисунок получен с помощью программы PyMOL.
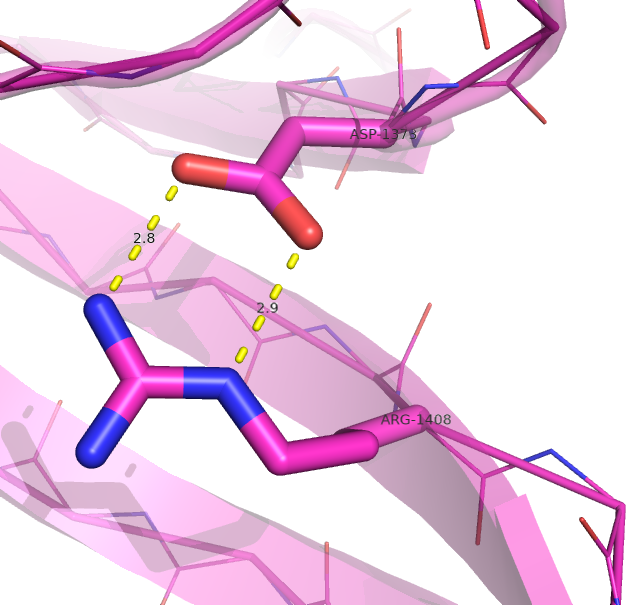
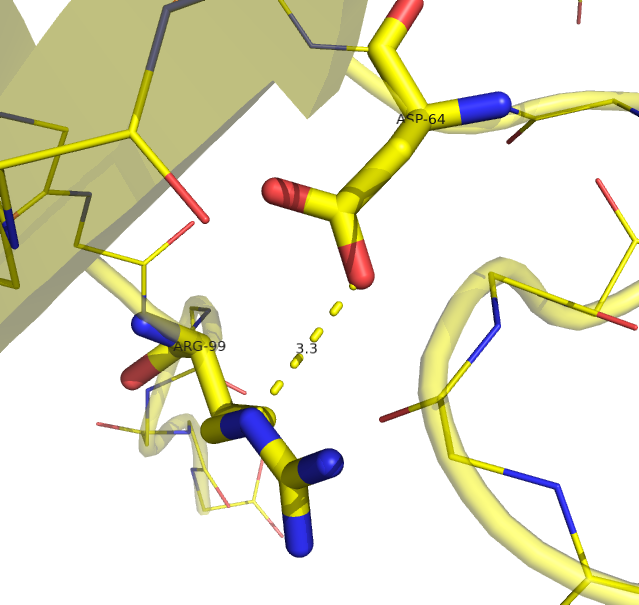
Рисунок 3. Водородные связи между петлёй и β-листом в структуре, расшифрованной с помощью РСА (слева) и ЯМР (справа).
Водородная связь показана прерывистой линией.
Рисунок получен с помощью программы PyMOL.
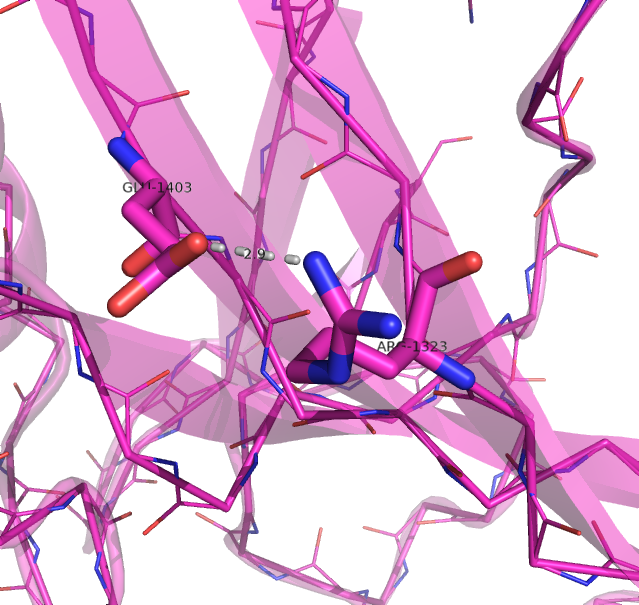
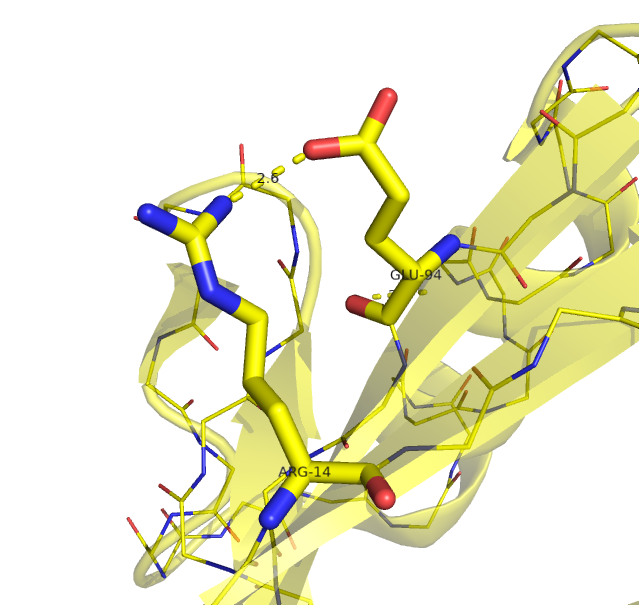
Рисунок 4. Водородные связи на поверхности β-листа в структуре, расшифрованной с помощью РСА (слева) и ЯМР (справа).
Водородная связь показана прерывистой линией.
Рисунок получен с помощью программы PyMOL.
Таким образом видно, что участки вне остова являются очень подвижными в белке (в ЯМР-структуре водородные связи в этих местах постоянно меняются). При этом измерения на ЯМР-структуре можно считать более точными, так как в структуре присутствуют атомы водорода, которые позволяют также оценить угол связи и таким образом убедиться в её подлинности.