Особенности мембранных белков
Задание №0
Из базы данных OPM были выбраны (почти случайным образом) шесть трансмембранных белков c различной функцией и строением: три бета-баррели и три альфа-спиральных белка. Для них была заполнена таблица (по ссылкам - соответствующие картинки):
| PDB код | Тип
(спираль, баррель) |
Какая мембрана (внутренняя или внешняя, организм, органелла) |
Толщина гидрофобной части мембраны в ангстремах | Медиана числа остатков в одном трансмембранном участке |
| 1kmo | баррель | внешняя мембрана грам-отрицательных бактерий | 24.5 +- 1.2 А | 9 |
| 1qd5 | баррель | внешняя мембрана грам-отрицательных бактерий | 24.6 +- 1.2 A | 8 |
| 3gp6 | баррель | внешняя мембрана грам-отрицательных бактерий | 14.7 +- 1.5 A | 8.5 |
| 1ots | спирали | внутренняя мембрана грам-отрицательных бактерий | 29.7 +- 0.8 А | 14 |
| 4h1w | спирали | мембрана ЭПР | 27.6 +- 1.0 А | 19 |
| 1lop | спирали | внутренняя мембрана митохондрий | 28.8 +- 2.0 А | 14 |
Задание №1
Данный мне белок - 3RZE (гистаминовый H1 рецептор человека). Как были найдены его гомологи:
- PSI-BLAST поиск по всем организмам, кроме Хордовых; выдача 1000 хитов, e-value 1e-7
- пять итераций бласта
- GenPept, к сожалению, не хотел работать с 1000 белков, поэтому пришлось воспользоваться Distance tree of results и выискивать там разные организмы
В итоге были выбраны следующие гомологи:
- |K7X591|, tyramine receptor type 1 [Pieris rapae]
- gb|AAK14402.1|AF343878_1, putative octopamine receptor [Mamestra brassicae]
- gb|AFX62896.1|, hypothetical protein DAPPUDRAFT_42083 [Daphnia pulex]
- gb|ABY71758.1|, tyramine/octopamine receptor [Macrobrachium rosenbergii]
- gb|ADI56271.1|, alpha-like octopamine receptor [Balanus improvisus]
- dbj|BAA11424.1|, G protein-coupled receptor [Amphibalanus amphitrite]
- gb|AFC88977.1|, alpha 2 adrenergic-like octopamine receptor [Rhipicephalus microplus]
- gb|AAQ95277.1|, type 1 serotonin receptor 5HT-1Hel [Planorbella trivolvis]
- dbj|BAE78591.1|, serotonin receptor [Hemicentrotus pulcherrimus]
- dbj|GAA29051.2|, 5-hydroxytryptamine receptor 7 [Clonorchis sinensis]
- ref|XP_002644614.1|, C. briggsae CBR-TYRA-3 protein [Caenorhabditis briggsae]
- emb|CCD78522.1|, putative amine GPCR [Schistosoma mansoni]
- dbj|BAI44327.1|, serotonin receptor 7 [Dugesia japonica]
- gb|ABB87182.1|, type 1 dopamine receptor [Panulirus interruptus]
- gb|EKC22048.1|, octopamine receptor [Crassostrea gigas]
Задание №2
С помощью OPM были найдены следующие сведения о выданном мне белке 3RZE:
| PDB ID | Организм | Тип мембраны | TC-код | Наклон спиралей (бета-тяжей) к нормали | Количество трансмембранных спиралей (бета-тяжей в бочонке) | Название белка |
| 3RZE | Homo sapiens | Плазматическая мембрана эукариот | 3.E.1 | 1 +- 1° | 6 (спиралей) | гистаминовый H1 рецептор |
Толщина гидрофобного слоя мембраны составляет 32.0 +- 1.4 A.
TC-код:
3: активные транспортеры, использующие первичные источники энергии (химическую, электрическую или солнечную энергию)
E: Транспортер, использующий поглощение света для переноски веществ через мембрану
1: Cемейство ион-транслоцирующих МР белков. Они катализируют перенос ионов при помощи солнечного света через мембраны или служат как рецепторы света (родопсин, зрительный пигмент).

На картинке красным отмечена внешняя сторона мембраны (+), синим - внутренняя (-).
Задание №3
Входной файл с последовательностями белковФайл с выравниваниями (muscle)
Для предсказания с помощью TMHMM был выбран белок AAK14402. Картинка с предсказания:
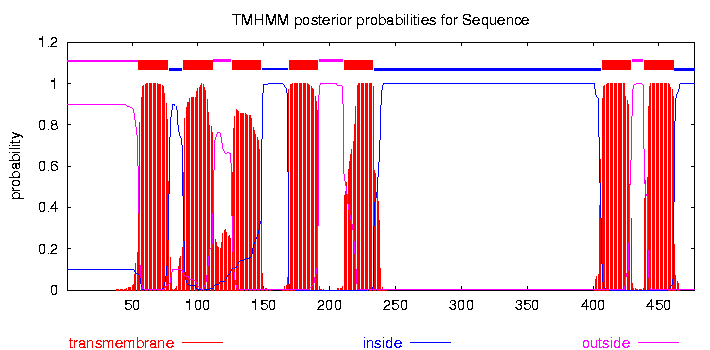
Порог для окрашивания по консервативности - 20.
Как видно из выравнивания и по покраске, наиболее консервативные участки соответствуют как раз трансмембранным спиралям, что логично. Между спиралями в отдельных последовательностях встречаются вставки. В промежуточных частях есть отдельные более или менее хорошо выровненные участки, но с выбранным порогом консервативности для окрашивания участков покрашенными оказались только трансмембранные спирали. Таким образом, наиболее консервативными участками являются на самом деле все трансмембранные спирали (их семь).
Самые гидрофобные остатки на схеме окрашены красным, гидрофильные - синим:
| I | V | L | F | C |
| M | A | G | X | T |
| S | W | Y | P | H |
| E | Z | Q | D | B |
| N | K | R |
В спиралях встречаются очень консервативные гидрофильные аминокислотные остатки. Некоторые из этих позиций можно обхяснить: например, доксепин (напомню, данная структура - гистаминовый H1-рецептор) связывается с очень консервативным триптофаном с "внутренней" части спирали. Рядом лежит анион-связывающий участок, который содержит в себе лизины. Помимо этих, есть еще и другие консервативные гидрофильные остатки. Как правило, они находятся между спиралями, то есть внутри образуемого ими "цилиндра", то есть непосредственно с мембраной не взаимодействуют, что логично.
Предсказание TMHMM в целом совпало с реальной известной структурой. Найдены все семь трансмембранных спиралей. Чаще всего предсказанные спиральные участки совпадают с реальными, либо немного меньше реальных. Также никакой "лишний" участок не был обозначен как спираль. Кроме того, TMHMM правильно определил, какие части белка расположены с внутренней стороны мембраны, а какие с внешней. Элементы вторичной структуры, расположенные с внутренней стороны мембраны (но не трансмембранные) определены не были. В целом можно сделать вывод об успешности предсказания TMHMM.
Jar-файл