Вторичная структура
В данном практикуме были рассмотрены алгоритмы разметки вторичной структуры и проанализированы аминокислотные остатки, преобладающие в определенных вторичных структурах.
Задание 1. Работа с разметкой вторичной структуры в ручном режиме
Для исследования разметки вторичной структуры различными алоритмами была использована структура 5E89, уже рассматриваемая в практикуме 6 и представляющая домен, узнающий углеводы, галектина-3 человека. Разметка вторичной структурs осуществлялась на сайте 2Struc алгоритмами DSSP и STRIDE. По рисунку 1 видно, что большую часть белка алгоритмы определяют одинаково, исключения в основном составляют пограничные участки между двумя различными вторичными структурами. Рассмотрим подробнее несколько спорных случаев.

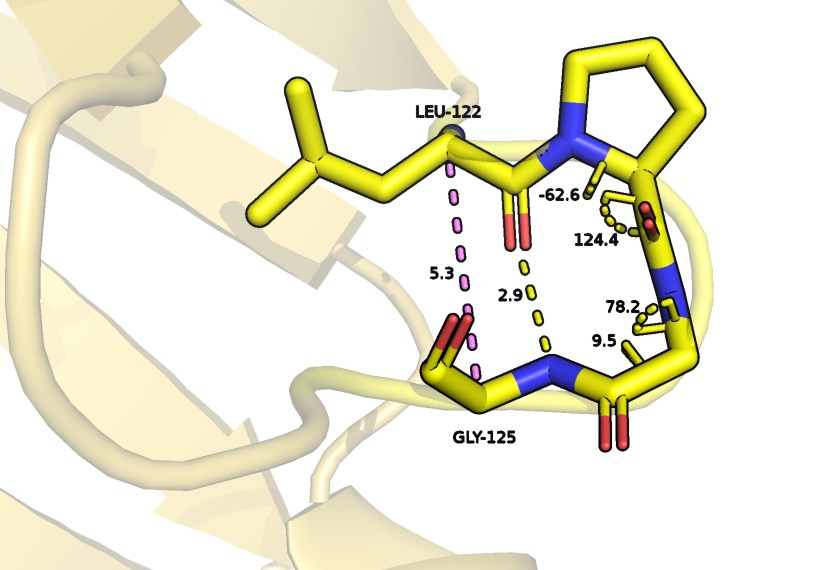
Остатки амнокислот от 122 до 125 STRIDE считает частью поворота, тогда как DSSP включает в него только аминокислотные остатки 123-124. Между кислородом Leu-122 и азотом Gly-125 образуется водородная смязь, что является признаком бета-поворота, на что указывает и расстояние меньше 7 ангстрем между Сα атомами. Вычислим геометрические параметры между атомами остова данного участка, чтобы определить соответствуют ли они параметрам поворота. Полученные значения указывают на то, что это действительно β-поворот II типа и аннотация STRIDE правильнее.
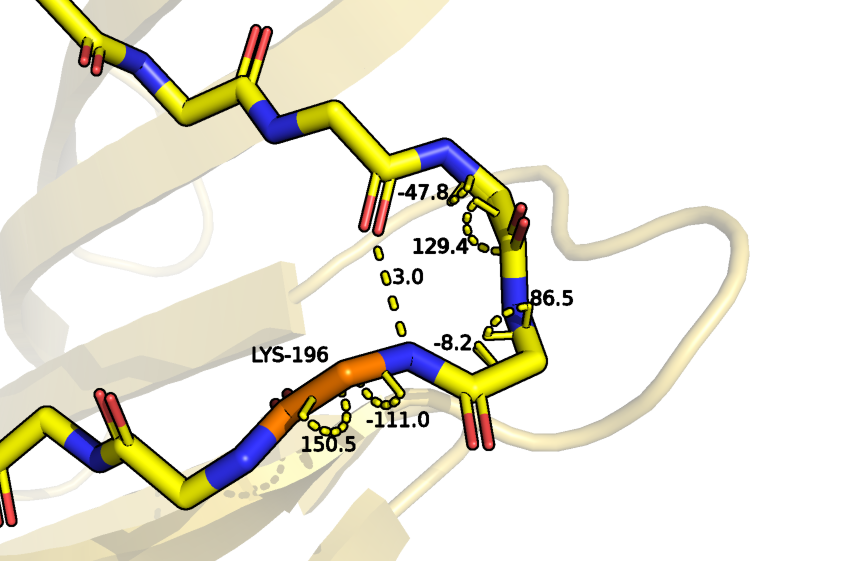
Рассмотрим еще один участок, в котором DSSP никак не аннотировал пограничные аминокислотные остатки (193 и 196). Тут похожая на предыдущий случай ситуация, I-ый аминокислотный остаток (Glu-193) образует водородную связь с i+3-им аминокислотным остатком (Lys-196), параметры торсионных углов φ и ψ аминокислотных остатков 194 и 195 соответствуют характерным значениям для этой структуры, то есть STRIDE аннотировал остатки вернее, но насчет 196 я не полностью согласн, так как по аналогии с первым случаем я бы аннотировала данный остаток как часть поворота, а не β-листа (хотя его торсионные углы близки к идеальным для остатков, составляющих β-лист).
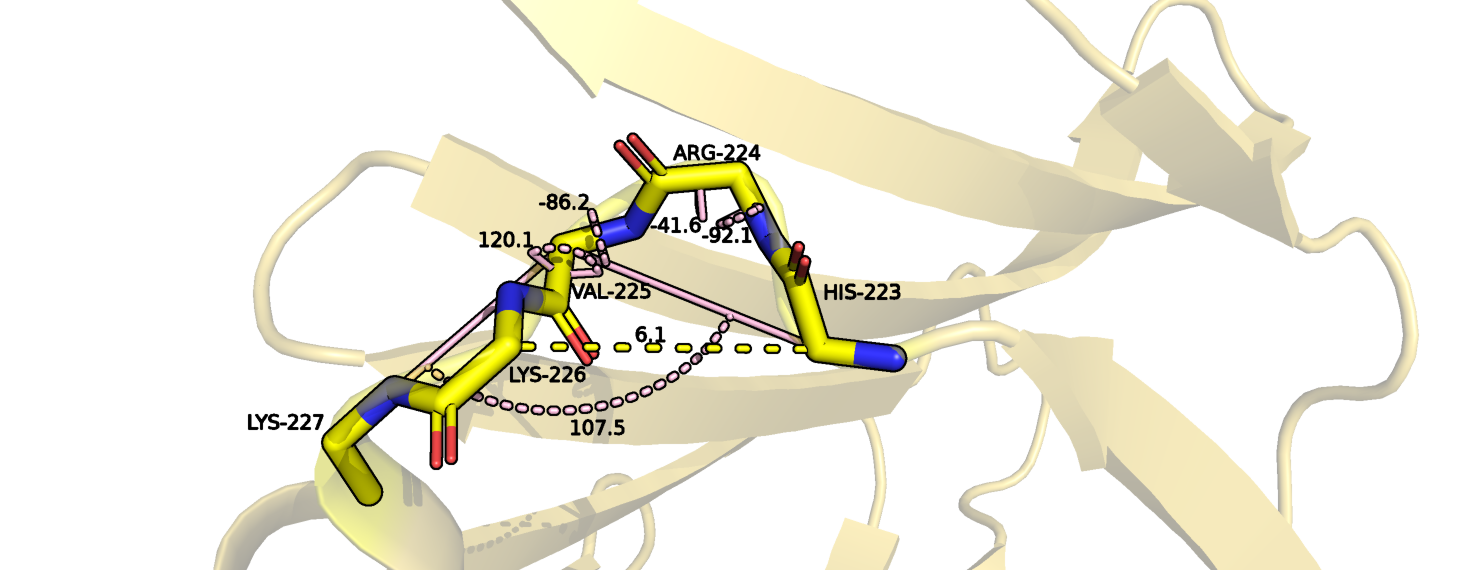
Проанализируем один из случаев несколько раз встречающейся ситуации, когда DSSP рассматривает участок как изгиб, а STRIDE как поворот, на примере аминокислотных остатков 224-225. Хотя между этими и их окружающими аминокислотными остатками нет водородной связи, у поворота есть и другой характерный признак: расстояние между Сα атомами терминальных аминокислотных остатков поворота должно быть меньше 7, что выполняется для His-223 и Lys-226, но при этом значения торсионных углов остатков между ними далеки от наблюдаемых для поворотов. Поэтому рассмотрим возможность того, что это изгиб. Для изгиба самый важный параметр это кривизна, и она определяется углом между вектором (Сαi - Сα(i-2)) и вектором (Сα(i+2) - Сαi). Измерить его можно вычтя из 180° угол между His-223, Val-225 и Lys-227. И так как полученное значение угла равное 72,5° больше требуемого значения (70°), то данный участок вероятнее всего является изгибом. Таким образом, DSSP точнее разметил данный участок, хотя я бы включила в изгиб также 223, 226 и 227 аминокислотные остатки.
Исходя из всего выше сказанного нельзя однозначно сказать, какой алгоритм лучше определяет вторичную структуру. Так, DSSP плохо определяет вторичную структуру аминокислотных остатков, находящихся между различными вторичными структурами, что связано с тем, что он не аннотирует терминальные аминокислоты. STRIDE хотя и производит оценку исходя не только из водородных связей, но и значений торсионных углов, тоже ошибается и не отличает изгибы от поворотов.
Задание 2. Работа с разметкой вторичной структуры в автоматическом режиме
Для оценки аминокислотных остатков, характерных для определенных вторичных структур было проанализировано 30 структур, разметка в которых генерировалась с помощью DSSP. Далее вычислялась склонность каждого аминокислотного остатка к образованию той или иной вторичной структуры по следующей формуле:
P_ik=(n_ik/n_i)/(N_k/N), где
P_ik-склонность аминокислотного остатка i образовывать тип вторичной структуры j
n_ik-количество остатков i в датасете, образующих тип вторичной структуры j
n_i-общее количество остатков i в датасете
N_k-общее количество остатков, образующих тип вторичной структуры j во всем датасете
N-общее количество остатков в датасете
Причем все, что не являлось α-спиралью (H) или β-листом (E) расценивалось как петля (C). По рисунку 5 можно сказать, что в состав α-спиралей чаще всего входят остатки аланина, лизина и глутамата, в состав β-листов - цистеина и валина, а в петлях встречаются чаще других глицин, аспартат и пролин. Присутствие в петлях пролина объяснимо, так как из-за отсутствия водорода у азота он не способен образовывать водородные связи, критические для поддержания вторичной структуры. Глицин редко встречается в α-спиралях и β-листах из-за своей высокой подвижности.