Описание области контакта белка и лиганда (кофермент-А) в структуре цитратсинтазы
Лиганды в структуре цитратсинтазы
В структуре белков любых живых организмах можно часто найти молекулы небелковой природы и даже ионы, которые нужны для того чтобы белок правильно выполнял необходимую функцию. Такие вещества и называются лигандами. Лиганды крайне разнообразны: это могут быть как сложные органические молекулы (например, гем), так и небольшие ионы металлов (в том числе и такие как ванадий, молибден, никель). Именно изучению взаимодействия белка и лиганда посвящена данная страница.
В файле PDB содержится информация о двух лигандах (в каждой субъединице белка показаны по две молекулы каждого типа):
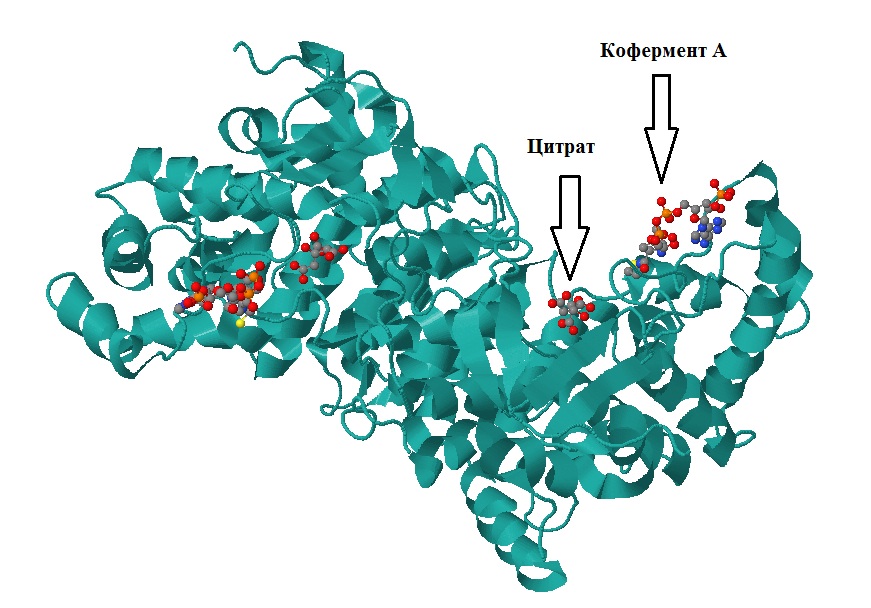
- Цитрат (лимонная кислота) - продукт катализируемой белком реакции (см. рис. 1,2).
- Кофермент A - органическая молекула, участвующая в переносе ацильных остатков (остатков карбоновых кислот). Участвует в катализируемой белком реакции в качестве донора ацетильного остатка. (см. рис. 1,2)
 |
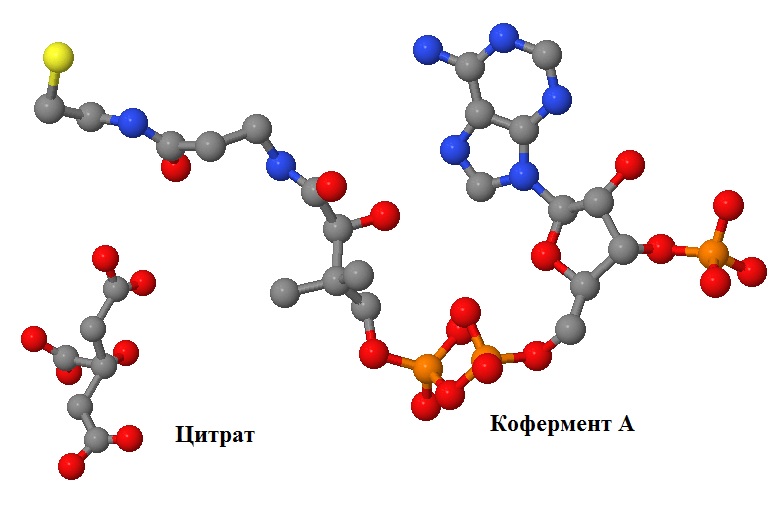 |
Рис. 1 Общий вид одной субъединицы цитратсинтазы. Белковый компонент покрашен голубым, атомы лигандов выделены стандартными цветами. [СКРИПТ] |
Рис. 2 Исследуемые лиганды: лимонная кислота (цитрат) и кофермент А. Атомы покрашены стандартными цветами. Масштаб сохранён. |
Также мною проведены измерения размеров белковой части комплекса и низкомолекулярных лигандов. Для белкового компонента приводятся три измерения: "длина", "ширина", "высота" (см. таб. 1). То, каким реальным линейным характеристикам молекулы они соответствуют, показано на рисунке 3. Для лигандов приведены значения расстояния между наиболее отдалёнными атомами в молекуле. Эти данные приведены в таблице 2.
Таблица 1 Измерение линейных параметров белкового компонента
| Единицы измерения | Нанометры (нм) | Ангстремы (10-10) | Метры (система СИ) |
| "Длина" | 8.3 | 83 | 8.3*10-9 |
| "Ширина" | 3.8 | 38 | 3.8*10-9 |
| "Высота" | 3.3 | 33 | 3.3*10-9 |
Таб.2 Измерение линейных параметров лигандов цитратсинтазы. Показано наибольшее расстояние между атомами в молекуле.
| Единицы измерения | Нанометры (нм) | Ангстремы (10-10) | Метры (система СИ) |
| Цитрат | 0.686 | 6.86 | 6.86*10-10 |
| Кофермент А | 2.071 | 20.71 | 2.071*10-9 |
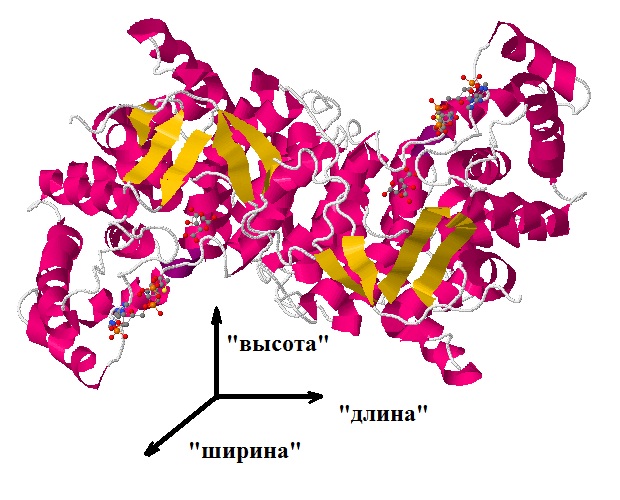 |
Рис. 3 Одна субъединица цитратсинтазы, на которой показаны оси измерения линейных размеров. |
Анализ области контакта белка из структуры PDB 2C6X и лиганда - кофермента А
Целью данной части работы было показать, каким же именно способом кофермент А связен с белковой частью комплекса, и какие аминокислотные
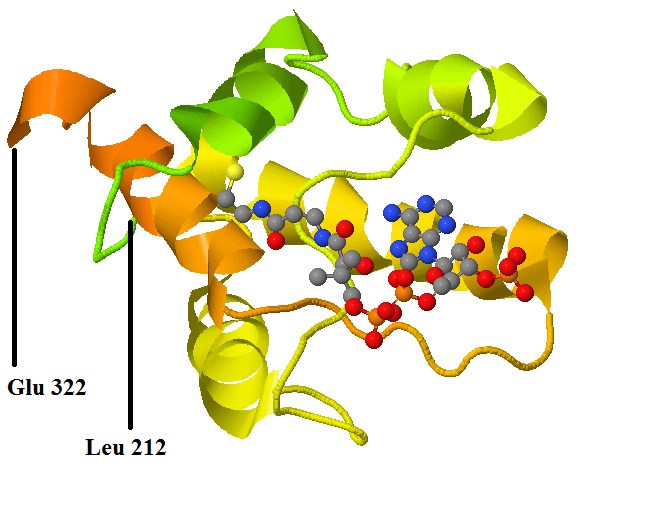
остатки в этом участвуют. В цепи белка можно выделить участок (остатки Leu 212 - Glu 322), с которой взаимодействует лиганд. В
дальнейшем на рисунках будет приводиться либо вся эта часть (рисунки 4 и 5), либо её фрагменты (рисунки 6 и 7).
На рисунке 4 представлена структура лигандсвязывающего участка. Видно, что кофермент А взаимодействует с частями цепи, которые не имеют
специфической вторичной структуры (альфа-спираль, бета-лист). На рисунке 5 можно видеть, что лиганд находится в углублении поверхности белка,
прикрытое сверху двумя радикалами аргинина (Arg 246, Arg 253), которые, связываясь с кислородами фосфатных групп в структуре лиганда, не дают ему покинуть
это углубление. Кроме того ещё два положительно заряженных остатка (Lys 297, Arg 300) стабилизируют положение лиганда, фиксируя третью его
фосфатную группу.
 |
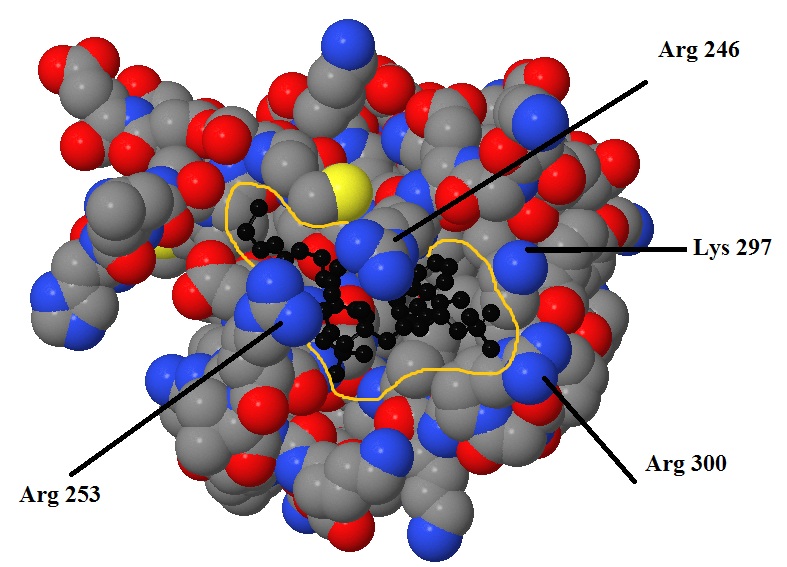 |
Рис. 4 Участок цепи А цитратсинтазы (Leu 212 - Glu 322), содержащий остатки, участвующие в связывании лиганда. Атомы лиганда - стандартное окрашивание. Цепь белка - градиент от зелёного к оранжевому. [СКРИПТ] |
Рис. 5 Изображение области контакта белка и лиганда. Атомы белка показаны стандартным цветом и имеют реальный радиус, атомы лиганда чёрные и показаны с более маленьким радиусом. Жёлтым обведено "углубление", занимаемое лигандом. Подписаны важные для взаимодействия аминокислотные остатки. |
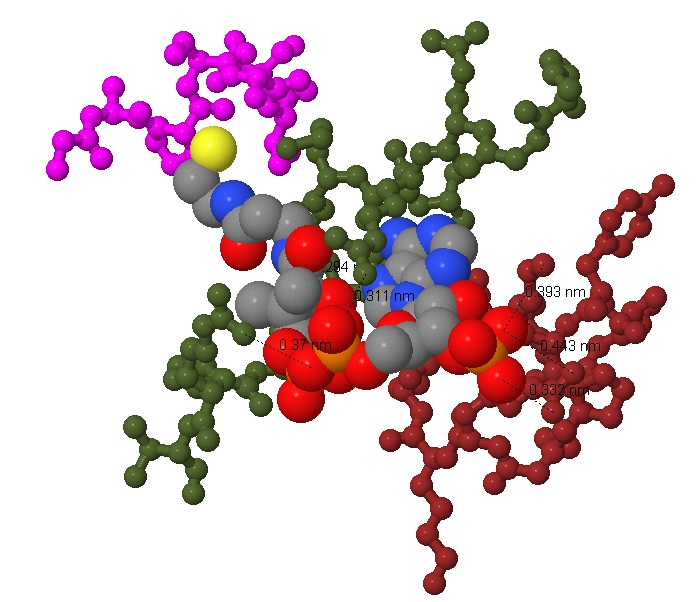
Рисунки 6 и 7 показывают более подробно, какие участки цепи и радикалы взаимодействуют с лигандом. Показаны длины ионных связей. Связывание лиганда обусловлено взаимодействием между противоположно заряженными группами: отрицательно заряженными кислородами фосфатных групп и положительно заряженными радикалами лизина и аргинина. Это проиллюстрировано на рисунке 8, где представлена схема взаимодействия, полученная с помощью программы ChemSketch. Кроме того в подписях к рисункам приведена ссылка на скрипт для Jmol, с помошью которого можно последовательно получить рисунки 1,4 и 7.
 |
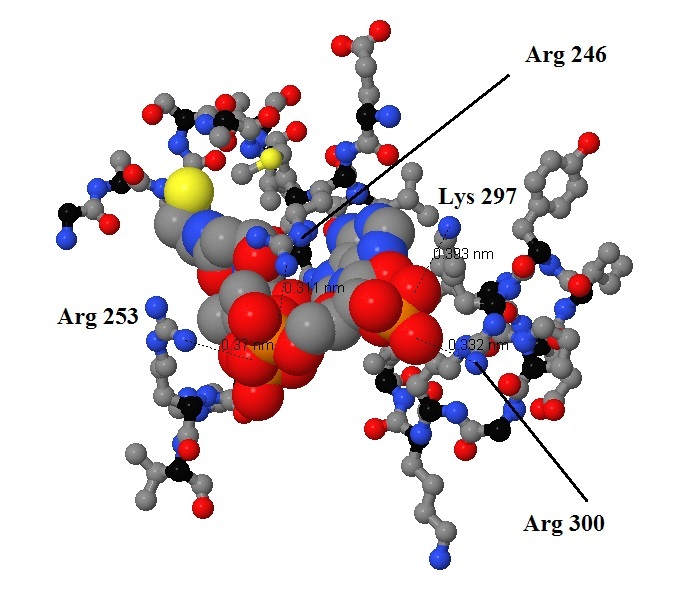 |
Рис. 6 Более подробное изображение белковых цепей, имеющих контакт с молекулой лиганда. Показаны 3 участка цепи (коричневый, фиолетовый, болотный), содержащие аминокислоты, контактирующие с лигандом. Атомы лиганда имеют реальный радиус, атомы белка - уменьшенный. |
Рис. 7 Взаимодействие конкретных аминокислот с лигандом. Показаны длины ионных связей между радикалами аминокислотных остатков и фосфатными группами лиганда. Подписаны важные для взаимодействия остатки. Атомы лиганда имеют реальный радиус, атомы белка - уменьшенный.[СКРИПТ] |
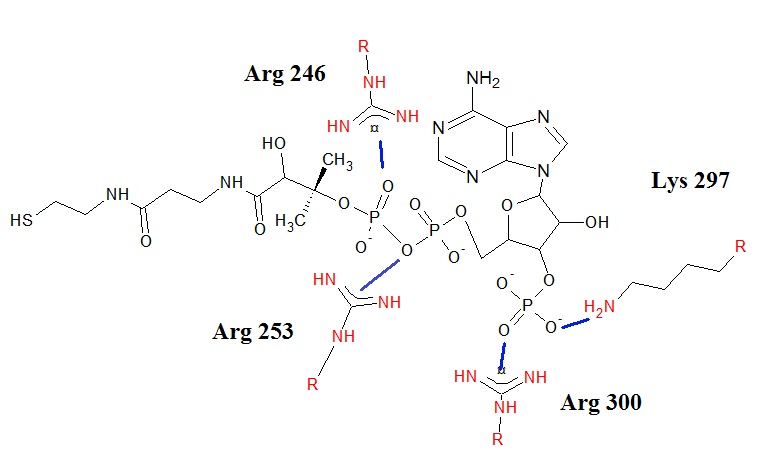 |
Рис. 8 Схематичное изображение области контакта белка и лиганда, показаны участвующие в нём остатки и те связи, которые они образуют с лигандом. |
Проект генно-инженерного эксперимента с белком из структуры 2С6Х
В этой части работы я предлагаю Вам совершить мысленный эксперимент и предположить, что произойдёт при замене определённых
аминокислотных остатков в участках цепи, участвующих в связывании лиганда, на другие, с иными свойствами.
Во-первых, стоит отметить, что замена одной
из пяти аминокислот, важных для связывания, на имеющую отрицательный заряд либо на не имеющую заряда, приведёт к ослаблению связывания
лиганда или к его прекращению, так как именно положительный заряд участвует во взаимодействии с отрицательным зарядом на фосфатных
группах лиганда.
Во-вторых, к похожим последствиям может привести появление в участках связывания крупнорадикальных аминокислот (Trp, Tyr, Phe и др.),
так как такие радикалы могут не позволить образоваться углублению в структуре белка, которое занимается лигандом.
В-третьих, остаётся только сказать, что замена определённых остатков на другие, но с радикалами, имеющими близкие свойства радикалов (например,
аргинина на лизин), вероятно, не приведёт к изменениям в силе связывания лиганда.
Дата последнего обновления: 14.12.2012
© Dmitry Travin, 2012