Внутримолекулярные взаимодействия в структуре цитратсинтазы
Общая характеристика структуры цитратсинтазы
- Название белка: Цитратсинтаза бактерии B. subtilis
- Идентификатор в базе данных PDB: 2C6X
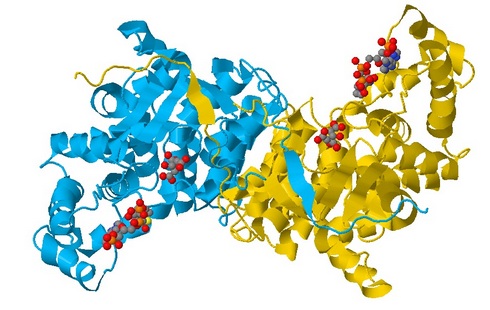
- Краткое описание структуры, количество цепей: белок представляет собой гомодимер, т.e. состоит из двух одинаковых субъединиц (см. рис. 1), каждая из которых включает в себя две одинаковые цепи (структура цепи - см. рис. 2) (таким образом, в PDB-файле всего 4 одинаковых белковых цепи). Для удобства на данной странице будут приводиться данные и картинки только для одной субъединицы, так как для второй всё абсолютно аналогично.
- Небелковые компоненты в PDB-файле: в файле PDB также приведены координаты четырёх молекул цитрата и четырёх молекул кофермента А(оба вещества являются продуктами катализируемой ферментом реакции)
 |
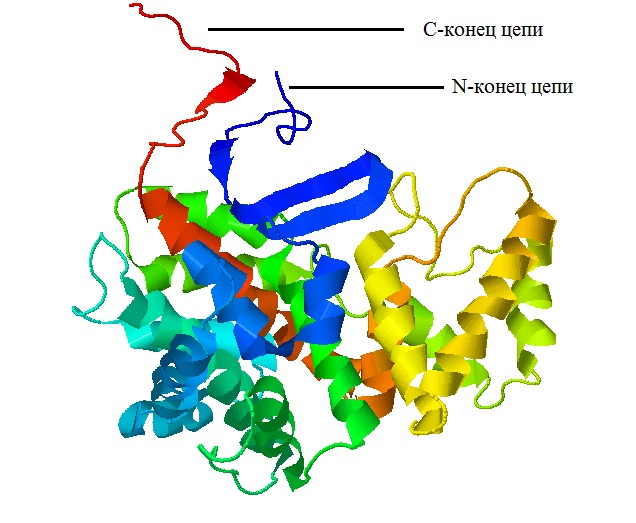 |
Рис. 1 Общий вид одной субъединицы цитратсинтазы: цепь А - голубой цвет, цепь В - золотой, небелковые лиганды покрашены стандартными цветами для атомов определённых элементов |
Рис. 2 Последовательность расположения различных групп из элементов вторичной структуры в одной из четырёх цепей цитратсинтазы. От N-конца к С-концу цвета изменяются градиентом от красного к синему. |
Анализ структуры альфа-спиралей и бета-листов в цепи B белка с кодом PDB 2C6X
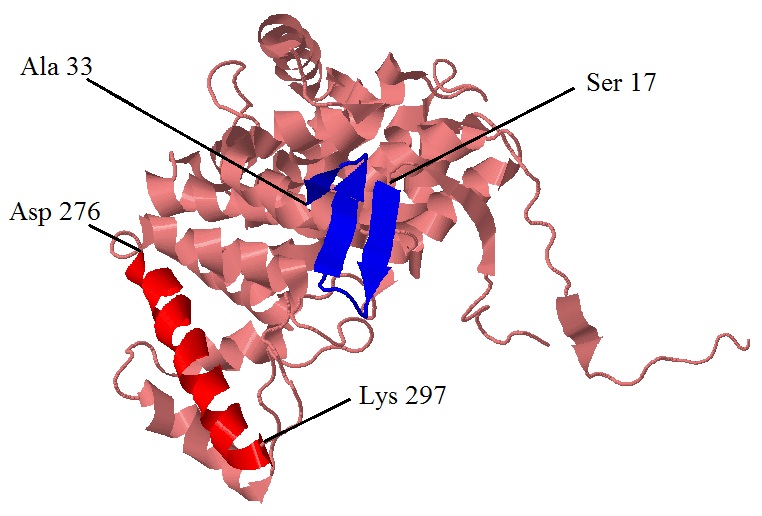
В этом разделе будет представлена характеристика двух произвольно выбранных элементов вторичной структуры белка: одного бета-слоя (из трёх бета-тяжей) и
одной альфа-спирали. Расположение этих элементов в структуре белка показано на рисунке 3.
В альфа спирали через каждые три витка атомы главной цепи (не боковых радикалов) занимают одинаковые позиции и могут быть соединены условной линией, которая будет
параллельна "оси" всей спирали. Из этих соображений был произведён расчёт длины шага альфа-спирали (см. рис. 4). Шаг спирали составил 5,53 ангстрема.
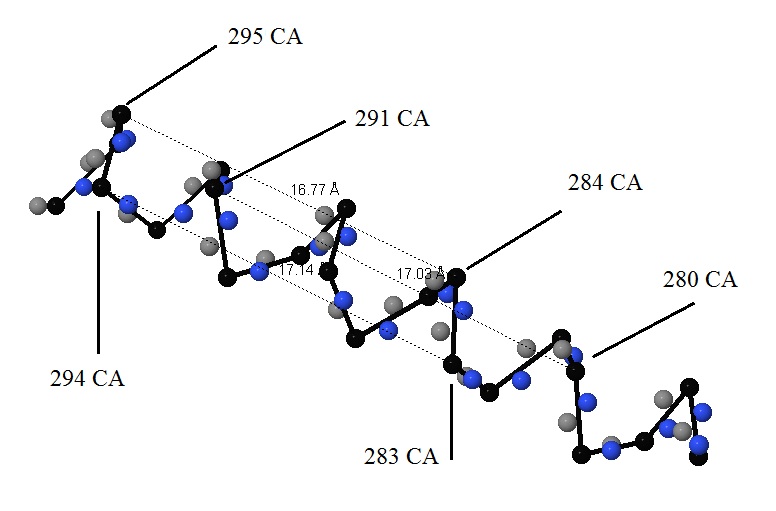
Также было подсчитано число остатков аминокислот на виток спирали. Одинаковые позиции (через 3 витка) занимают атомы каждого 11-го аминокислотного остатка (см. рис. 5), а следовательно:
11/3 = 3,67 аминокислотных остатка на один виток спирали.
На рисунке 6 (см. рис. 6) представлено изображение некого аминокислотного остатка n и двух водородных связей, которые он образует с остатками n+4 (c помощью карбоксильной группы)
и с остатком n-4 с помощью аминогруппы. Стоит отметить, что линии, соединяющие азот и кислород, - лишь схематичное изображение связи, так как в водородной связи есть ещё
атом водорода, на рисунке не показанный.
 |
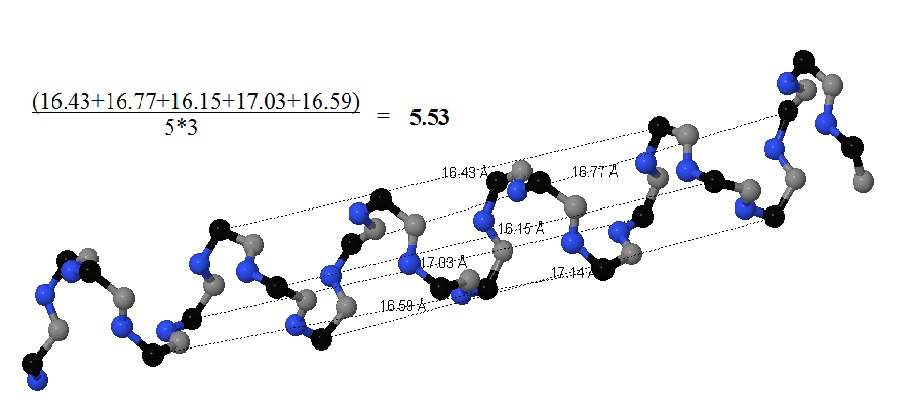 |
Рис. 3 Описываемые альфа-спираль и бета-лист на структуре цепи В цитратсинтазы. Подписаны аминокислотные остатки начала и конца каждого из выбранных элементов вторичной структуры. |
Рис. 4 Измерение шага альфа-спирали на основе анализа расстояний между СА, находящимися на одинаковых позициях в спирали. Чёрный - С-альфа атомы, серый - атомы углерода карбонильных групп, синий - азот в иминогруппах, боковые радикалы цепи не показаны. |
 |
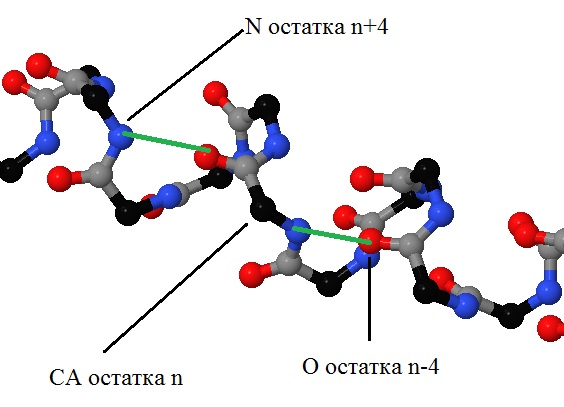 |
Рис. 5 Измерение числа аминокислотных остатков в одном витке спирали. Показаны номера остатков, находящихся в альфа-спирали в одинаковом положении. Чёрный - С-альфа атомы, серый - атомы углерода карбонильных групп, синий - азот в иминогруппах, боковые радикалы цепи не показаны. С-альфа атомы соединены чёрными линиями (backbone) |
Рис. 6 Расположение водородных связей при n-ом аминокислотном остатке в альфа-спирали. Зелёными линиями связаны азот и кислород, эти линии олицетворяют ось водородной связи. Атомы покрашены стандартными цветами. |
Выбранный бета-лист состоит из трёх бета-тяжей, образующих плоскую поверхность (см. рис. 7,8), хотя самый маленький из листов немного выбивается из плоскости образуемого листа. Исследуемый бета-лист является антипараллельным, так как направление движения цепи в двух тяжах отличается. Водородные связи и расположение атомов основной цепи белка в бета-тяже показано на рисунке 9 (см. рис. 9)
 |
 |
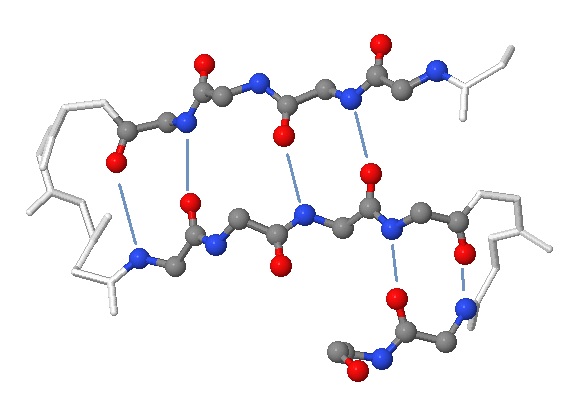 |
Рис. 7 Устройство выбранного бета-слоя, вид "спереди". Бета-тяжи показаны жёлтым, участки связывания бета-тяжей - белым. |
Рис. 8 Устройство выбранного бета-слоя, вид справа относительно рисунка 7. Бета-тяжи показаны жёлтым, участки связывания бета-тяжей - белым. |
Рис. 9 Водородные связи в бета-листе. В бета-тяжах атомы покрашены стандартно, линкерные участки - белые. Расположение водородных связей показано голубыми линиями (6 штук). Боковые радикалы не показаны. |
Внутримолекулярные взаимодействия боковых групп белка в цепи B структуры 2C6X
В цитратсинтазе обнаружено 8 цистеинов (по два в каждой из восьми цепей), но расстояния между ними слишком велики для образования дисульфидных связей.
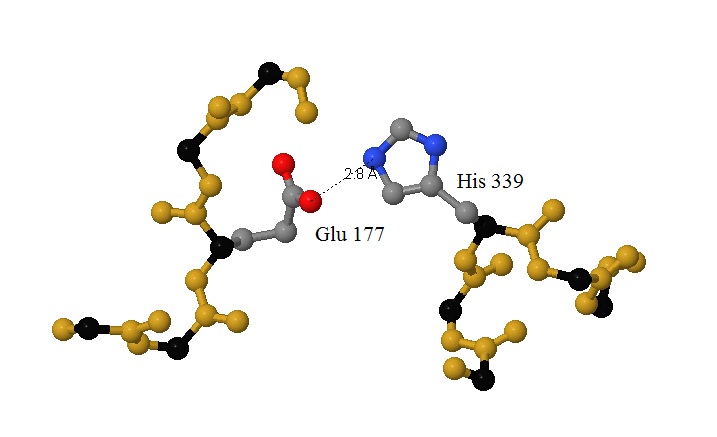
Между положительно заряженными (гистидин, лизин, аргинин) и отрицательно заряженными (аспартат, глутамат) аминокислотами могут возникать солевые мостики. Длина такой связи
не превышает 4-х ангстрем. В исследуемой цепи найдено 24 возможных сайта образования таких мостиков. два из них приведены на рисунках ниже (см. рис. 10, 11).
 |
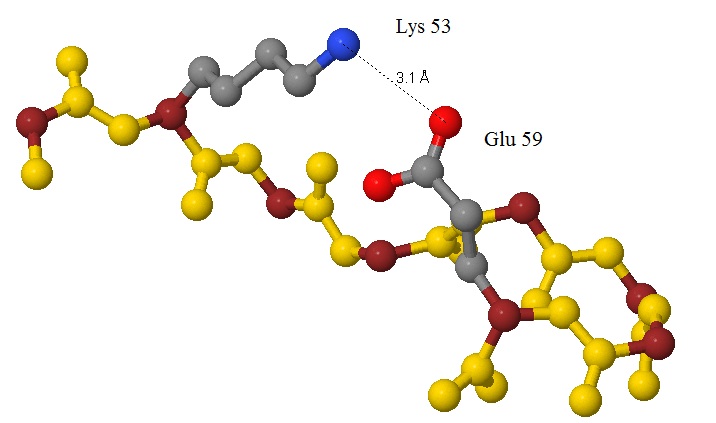 |
Рис. 10 Солевой мостик (длина 2,8 Ангстрема) между отдалёнными остатками аминокислот. В стандартные цвета покрашены радикалы, образующие мостик. Для остатков окружения не показаны боковые радикалы, все С-альфа атомы выделены чёрным. |
Рис. 11 Солевой мостик между близлежащими остатками аминокислот. В стандартные цвета покрашены радикалы, образующие мостик. С-альфа - коричневый, остов цепи - жёлтый. |
Дата последнего обновления: 29.11.2012
© Dmitry Travin, 2012