Построение и визуализация электронной плотности (ЭП)
Описание выбранного белка
Для работы в данном и последующих практикумах был выбран один из основных ферментов центрального метаболизма - енолаза. Енолаза катализирует обратимую реакцию превращения 2-фосфоглицерата (2-PGA) в фосфоенолпируват (PEP). В PDB-записи 3QTP приводится информация о структуре этого фермента у дизентерийной амёбы (Entamoeba histolytica), которая является возбудителем опасного заболевания - амёбиаза. Впоследствии для краткости будем называть фермент EhENO (Entamoeba histolytica enolase).Информация о структуре, её сравнение с другими структурами енолаз и другие аналитические данные приведены в статье:
Schulz, E. C., Tietzel, M., Tovy, A., Ankri, S., & Ficner, R. (2011). Structure analysis of Entamoeba histolytica enolase. Acta Crystallographica. Section D, Biological Crystallography, 67(Pt 7), 619–27. doi:10.1107/S0907444911016544Некоторые характеристики структуры:
- Количество полипептидных цепей: 2 (А и В)
- Разрешение: 1.90Å
- R-value: 0.155
- R-value (free): 0.202
Изображение ЭП вокруг полипептидной цепи
Были построены визуализации электронно плотности вокруг полипептиднй цепи без боковых остатков для трёх уровней подрезки (σ=0.5,1 и 2). Для визуализации был использован script_1. Полученные изображения представлены на рисунке 1. Можно отметить, что наиболее приемлемое изображение ЭП достигается при σ=1, когда нет "непокрытых" ЭП участков и ЭП не так "объёмна" как при уровне срезки 0,5.  |
 |
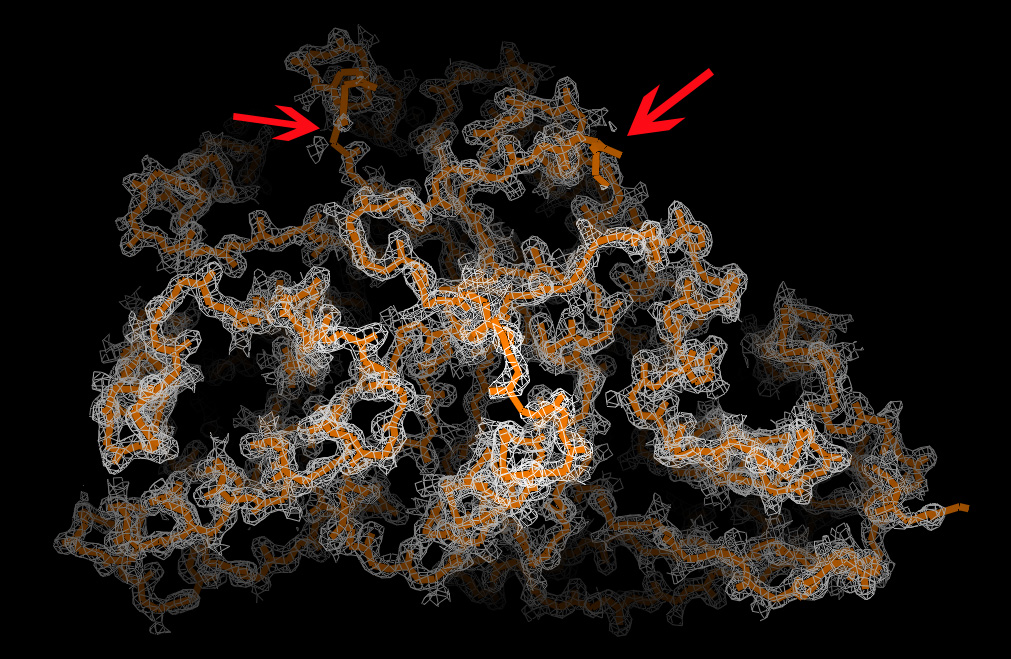 |
Рис. 1 Визуализация электронной плотности вокруг остова белковой цепи при различных уровнях подрезки: слева направо:σ=0.5, σ=1 и σ=2. Красными стрелками отмечены участки, где при уровне срезки 2 белковая цепь не покрыта электронной плотностью. |
||
Изображение ЭП вокруг нескольких боковых радикалов полипептидной цепи
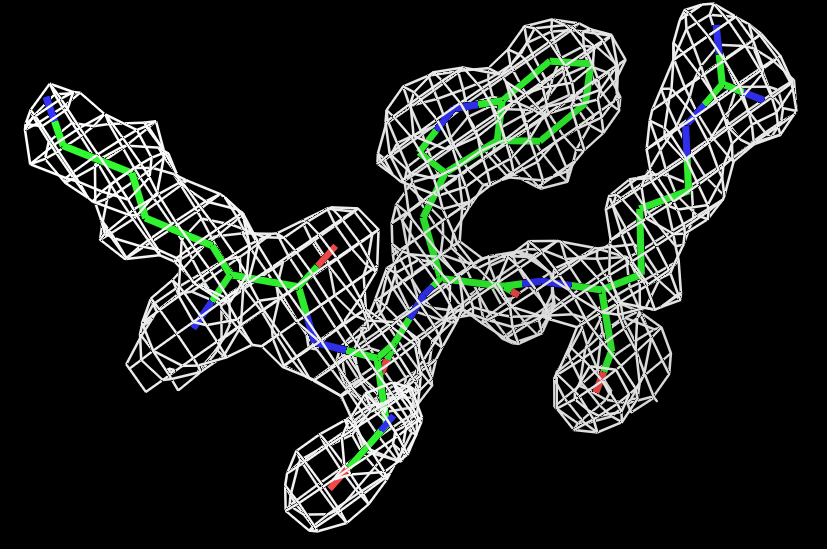
Для визуализации электронной плотности вокруг нескольких аминокислотных остатков был выбран участок из 4-х остатков цепи А с 429-го по 432-ой, состоящий из различных по физико-химическим свойствам остатков: лизина, аспарагина, триптофана и аргинина. Для визуализации использовался script_2. Результаты для трёх уровней подрезки (σ=0.5,1 и 1.5) представлены на рисунке 2. 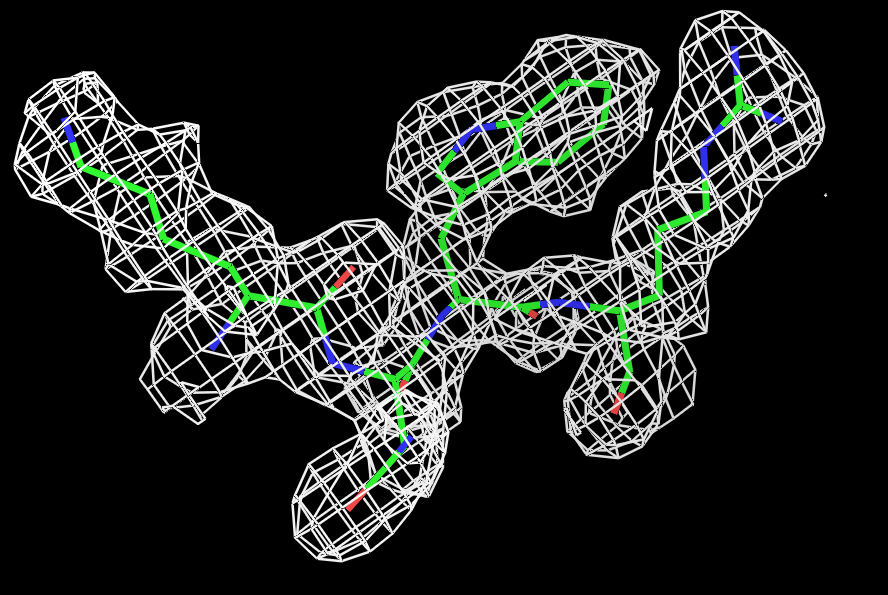 |
 |
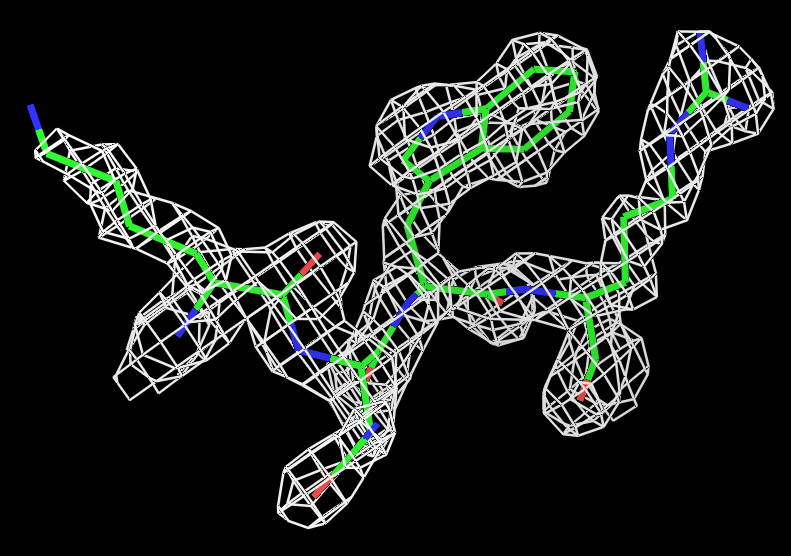 |
Рис.2 Визуализация электронной плотности вокруг четырёх боковых остатков полипептидной цепи (429:432) на разных уровнях подрезки: слева направо:σ=0.5, σ=1 и σ=1.5. |
||
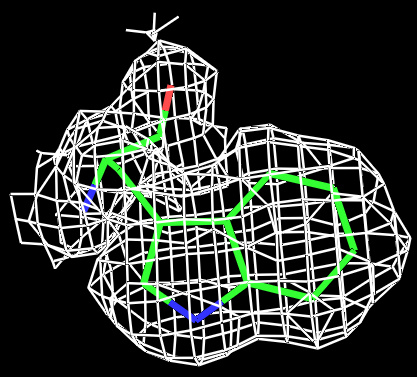 |
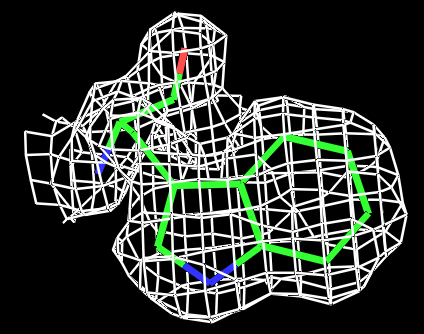 |
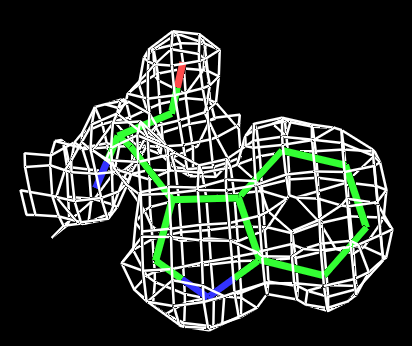 |
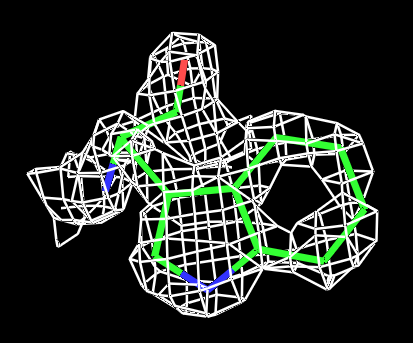 |
Рис.3 Визуализация электронной плотности вокруг остатка TRP431 на разных уровнях подрезки: слева направо:σ=0.5, σ=1, σ=1.5 и σ=2. |
|||
Дата последнего обновления: 17.11.2015
© Dmitry Travin, 2015