Восстановление кристаллической ячейки для белка 3QTP
Из PDB-файла для структуры 3QTP (строка CRYST1) были полученные следующие кристаллографические характеристики:
- Длины векторов кристаллической решётки (в Å): a=64.42, b=92.62, c=160.58
- Углы между векторами кристаллической решётки (в градусах): α=90, β=90, γ=90
- Число молекул в ячейке кристалла: 8
- Кристаллографическая группа: P 21 21 21 - примитивная группа с винтовой осью типа 21 по всем осям.
Затем при помощи команды
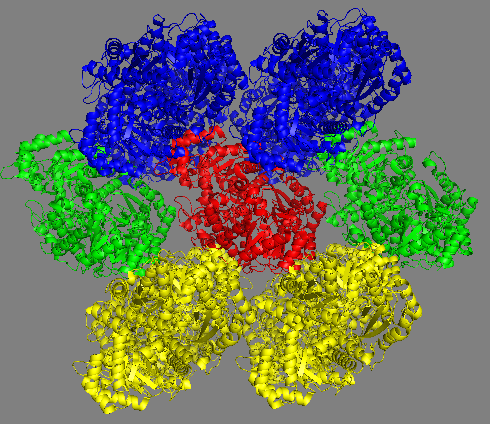
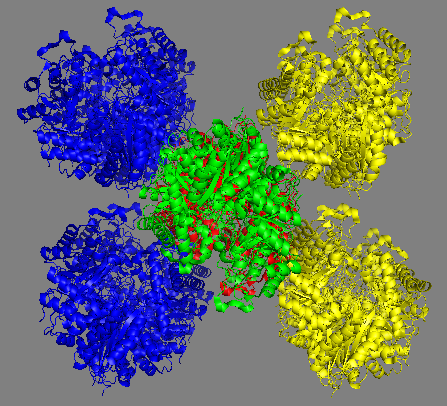
symexp sym, 3QTP, all, 3 было получено изображение расположения соседних с данной молекул в структуре кристалла. Результат приведён на рисунке 1.
 |
 |
 |
 |
Рис. 1 Молекулы, окружающие центральную молекулу (показана красным), в структуре кристалла. Каждая молекула является димером из цепей А и В. Молекулы окружения показаны различными цветами для облегчения понимания картинки, представлены (слева направо) три проекции и пространственное изображение, включающее вид трёх соседних ячеек кристалла (в каждой содержится по четыре молекулы димера, всего восемь молекул, димеры, которые можно получить друг из друга путём преобразований кристаллографической симметрии показаны одинаковым цветом). |
Изучение межмолекулярных контактов, поддерживающих структуру кристалла
Для изучения гидрофильных контактов между соседними белками в кристалле были выделены водородные связи в зоне контактов между парами белков. Каждый белок в структуре имеет 10 различных зон контактов (по числу соседей у одного белка), здесь будут рассмотрены три из них. Для визуализации водородных связей был применён следующий набор команд:
select set1, 3QTP and resn Lys+Arg+His+Tyr+Asp+Glu+Ser+Thr+Cys+Asn+Gln
select set3, 5ob and resn Lys+Arg+His+Tyr+Asp+Glu+Ser+Thr+Cys+Asn+Gln
select wow, resn HOH and (set3 around 3.5) and (set1 around 3.5)
show sticks, byres (set1 and (set3 around 3.5))
show sticks, byres (set3 and (set1 around 3.5))
distance hbonds_2, set3, set1 , 3.5, 2
set sphere_scale, 0.25
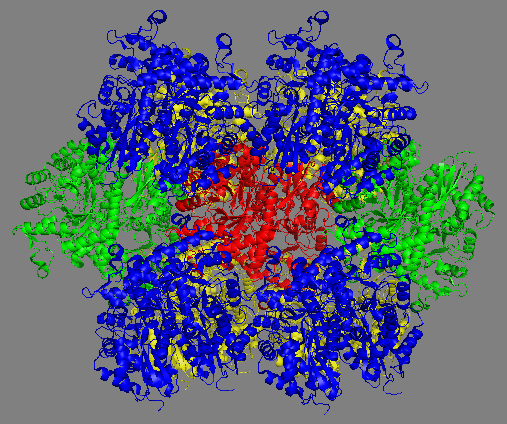
На рисунке 2 показаны три различные области контактов для одного из белков в кристалле. Вторым вариантом взаимодействия белков наряду с гидрофильными контактами могут быть гидрофобные взаимодействия, которые, в том числе могут приводить к олигомеризации белков. На рисунке 3 показаны белки в кристалле и окружающие их молекулы воды. Синим цветом на поверхности белка показаны гидрофобные области.
 |
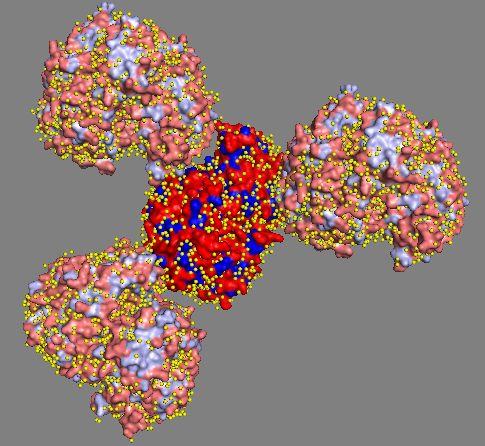 |
Рис. 2 Контакты между белком и его соседями в кристалле, в формировании которых участвуют водородные связи. Молекулы белков показаны в стиле cartoons различными цветами. В областях контактов показаны полярные остатки, лежащие в пределах 3,5 Å от полярных остатков другого белка. Возможные водородные связи показаны жёлтым пунктиром, подписаны длины. На верхней правой схеме зоны контактов шариками показаны молекулы воды, присутствующие в зоне контакта. |
Рис. 3 Гидрофобные участки поверхности (показаны синими оттенками) на поверхности белков в кристалле. молекулы воды показаны жёлтыми сферами. Видно, что нет чётко выделяющихся областей с преобладание гидрофобных остатков, вода равномерно покрывает белок, включая области контактов (см. Рис. 3). |
На основе приведённой информации можно сказать, что рассмотренные контакты если и вносят, то весьма ограниченный вклад в формирование кристалла, так как полярные контакты (включая водородные связи между молекулами) малочисленны, а гидрофобные контакты между соседними димерами, скорее всего, отсутствуют. Димер, при этом, является природной формой существования фермента в растворе, это же мы видим и в кристалле, олигомеризации при кристаллизации не наблюдается.
Объяснение странного расположения белковых цепей в структуре ДНК-белкового комплекса 3hdd
При загрузке структуры 3hdd в PyMol виден участок ДНК, с которым связаны два небольших белка (гомеодомена из
D.melanogaster). Один из двух белков находится на самом "краю" молекулы ДНК, и кажется несколько неестественно связанным с ней (см. Рис. 4). Результаты восстановления соседней ячейки кристалла в структуре приведены на рисунке 5.
 |
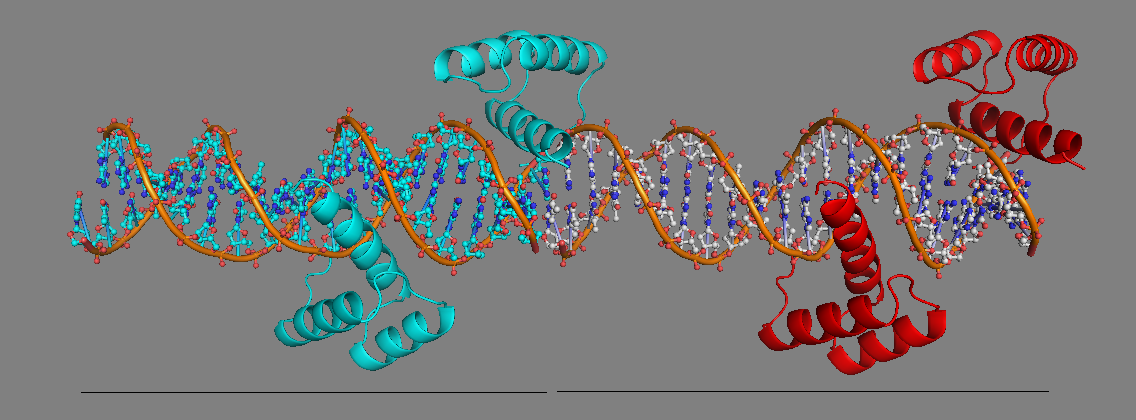 |
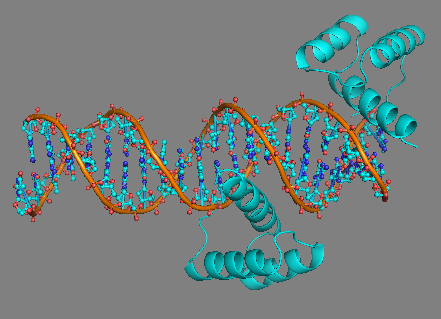
Рис. 4 Структура 3HDD, виден участок ДНК со связанными с ним двумя белковыми глобулами. Правая глобула несколько неестественно связана с молекулой ДНК. |
Рис. 5 Восстановление соседней ячейки кристалла, показан "сосед" с той стороны, где наблюдается "необычное" взаимодействие белка с ДНК. |
Рассматривая приведённые рисунки становится понятна причина странности: конец ДНК в данном двуцепочечном фрагменте является липким, на нём присутствует один неспаренный нуклеотид, что позволяет участкам ДНК двух соседних комплексов взаимодействовать, образуя водородные связи между концевыми нуклеотидами и формируя stacking-взаимодействия. Молекула же белка в кристалле взаимодействует с обоими фрагментами ДНК (см. Рис. 6), если же убрать один из соседних комплексов, то получается, что белок оказывается "зависшим на краю".
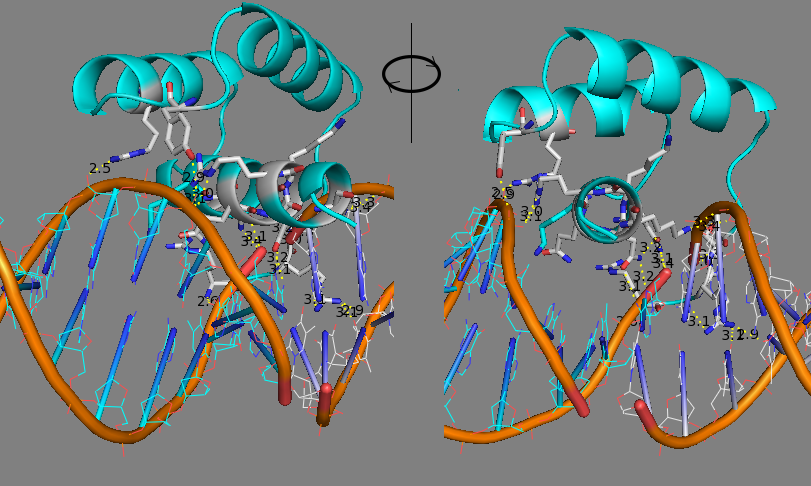 |
Рис. 6 Взаимодействие полярных боковых радикалов аминокислот в альфа-спирали гомеодомена с сахаро-фосфатным остовом в двух фрагментах ДНК из комплексов, располагающихся в соседних ячейках кристалла. Жёлтым пунктиром показаны возможные водородные связи. Приведены два ракурса. |








