Определение вторичной структуры алгоритмами DSSP и Stride
Для структуры 3QTP было проведено выделение участков вторичной структуры на основе данных, содержащихся в PDB файле. Результаты работы обеих программ дотупны по ссылкам:
Выдача DSSP и
Выдача Stride. Оба алгоритма запускались при помощи web-интерфейсов (
DSSP Interface и
Stride Interface соответственно).
На рисунке 1 приведена таблица сравнения границ участков вторичной структуры для четырёх элементов. Видно, что, в целом, значения между столбцами таблицы варьируют не сильно, для альфа-спиралей отмечу, что оба алгоритма не включают в состав спирали граничные остатки, входящие в спираль в файле PDB. Бета-тяжи описаны сходно, второй бета-тяж вообще имеет идентичные границы во всех трёх сравниваемых описаниях вторичной структуры.
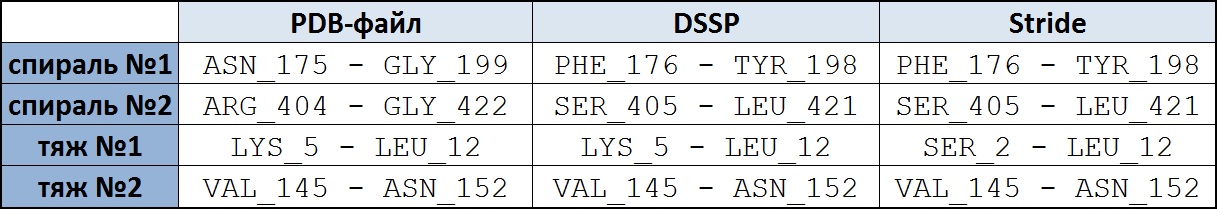 |
Рис. 1 Таблица сравнения границ четырёх элементов вторичной структуры (двух бета-тяжей и двух альфа-спиралей) в заголовке файла pdb и выдаче программ DSSP и Stride. Нумерация атомов всюду как в файле PDB. |
Построение карты бета-листа при помощи SheeP
С помощью программы SheeP были получены карты для всех бета-листов в pdb-файле 3QTP. Карты доступны по
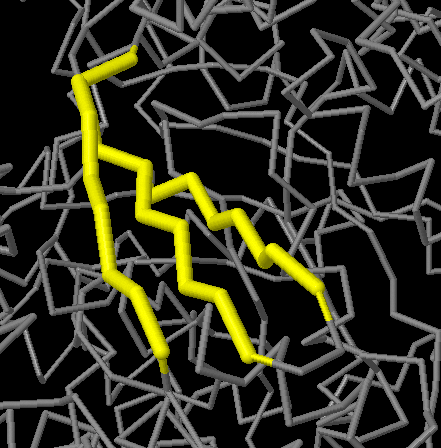
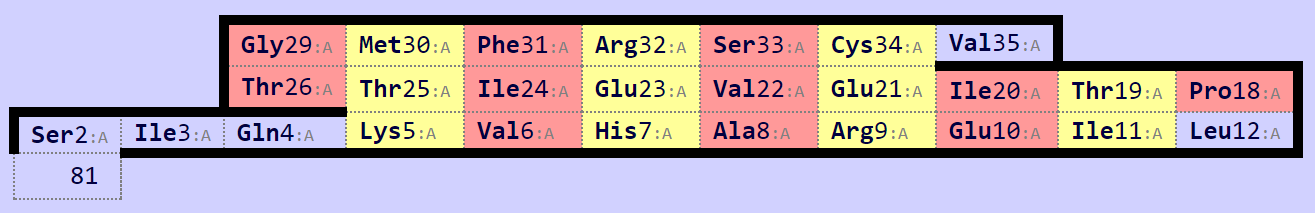
ссылке. Для дальнейшего рассмотрения мною был выбран самый перый бета-лист в выдаче SheeP. Он состоит из трёх бета-тяжей (Gln4-Ile11, Thr19-Thr26 и Gly29-Val35) и является антипараллельным. карта выбранного листа представлена на рисунке 2, остатки, радикалы которых направлены в разные стороны от плоскости бета-листа показаны красным и жёлтым цветами на карте. На рисунке 3 приведён ряд изображений рассматриваемого элемента вторичной структуры.
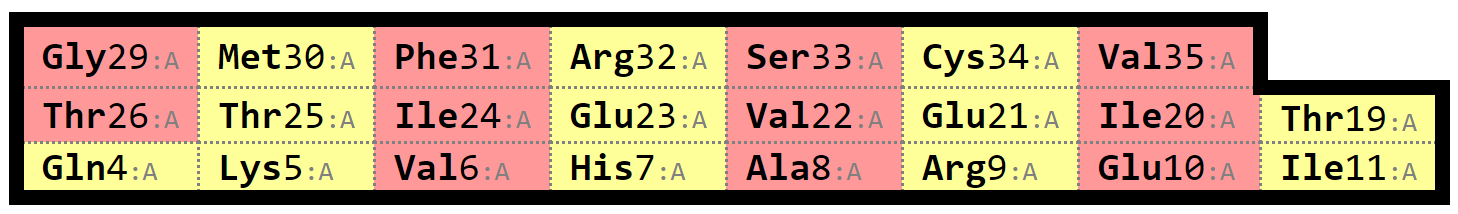 |
Рис. 2 Карта бета-листа, полученная из выдачи программы SheeP. |
 |
 |
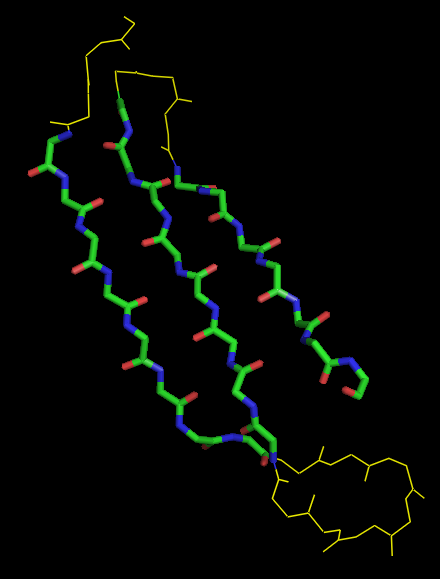 |
Рис. 3 Слева направо: изображение из Jmol, полученное по ссылке из SheeP, изображения полученные с помощью Pymol c различной визуализацией (cartoons и lines с покраской по типу атома). |
На карте бета-листа один столбец соответствует хребту из альфа атомов (и, соответственно, радикалов аминокислотных остатков) в структуре. Продемонстрируем это: на рисунке 4 приведен рассматриваемый бета лист (с радикалами и без), остатки одного столбца покрашены одним цветом. Видно, что, действительно, формирующиеся на поверхности бета-листа гребни состоят из остатков, определённых на карте в один столбец.
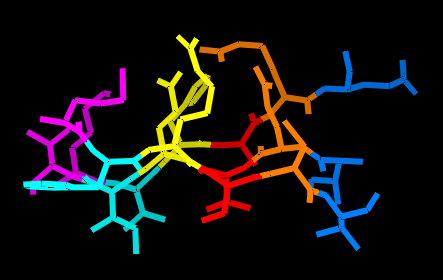 |
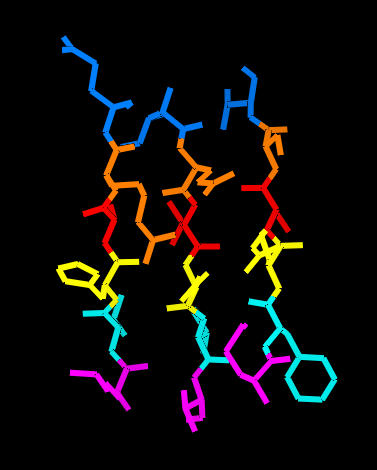 |
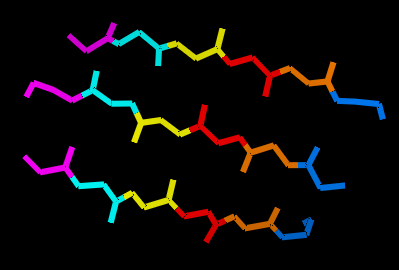 |
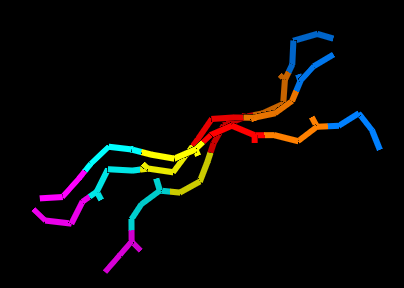 |
Рис. 4 Визуализация гребней в бета-листе. Остатки из одного столбца карты показаны одним цветом. Два левых изображения показывают бета-лист с боковыми радикалами, два правых - без них. |
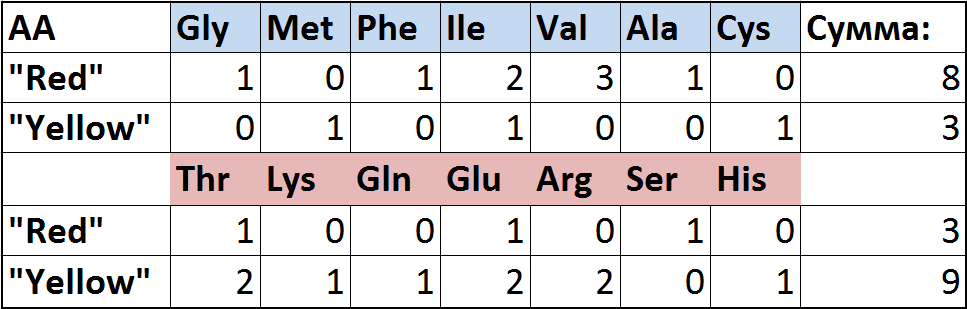
Попробуем определить, какая из сторон бета-листа обращены внутрь белка (к гидрофобному ядру), а какая наружу - в гидрофильное окружение. Для этого сначала сравним набор аминокислот "красной" и "жёлтой" сторон листа по карте. На рисунке 5 приведена таблица, в которой показано распределение гидрофильных (показаны красным фоном) и гидрофобных (показаны синим фоном) аминокислотных остатков между сторонами бета-листа. Видно, что на "красной" стороне преобладают гидрофобные остатки, а на жёлтой - гидрофильные. Исходя их этого логично было бы предположить, что "красная" сторона обращена внутрь, а "желтая" в гидрофильное окружение белка.
Теперь попробуем проверить высказанное предположение при помощи визуализации расположения всех остатков относительно поверхности белка. Для этого паскрасим остатки в структуре белка теми же красным и жёлтым цветами, как они показаны на крте бета-листа. Полученный результат представлен на рисунке 6.
 |
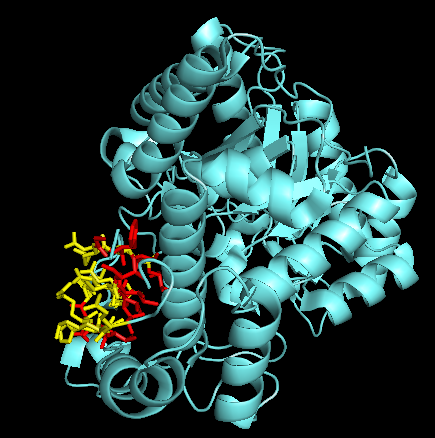 |
Рис. 5 Распределение аминокислотных остатков, различных по свойствам между сторонами бета-листа. Стороны условно обозначены как жёлтая и красная в соответствии с картой бета-листа (см. Рис.2), гидрофобные аминокислотные остатки показаны синим, а гидрофильные красным. |
Рис. 6 Остатки двух сторон бета-листа на поверхности структуры всего белка. Видно, что красные остатки обращены преимущественно к гидрофобному ядру, а жёлтые к гидрофильному окружению - к поверхности белка. |
Далее для рассматриваемого бета-листа была создана карта водородных связей на основе выдачи программы Stride. Была получена модификация исходной карты (дополнительное условие beta-sheets detector: Original STRIDE) (Рис. 7) и получен список водородных связей при помощи конольной версии програмыы Stride -
Ссылка. На рисунке 8 показана карта связей между атомами в трёх тяжах антипараллельного бета листа. Раскраска приведена по типу атомов. Наиболее типичны связи типа N-H...O между соседними бета-тяжами. Показаны водородные связи для пяти центральных хребтов в листе, по карте (Рис.7) видно, что в центральной части листа нерегулярностей нет.
 |
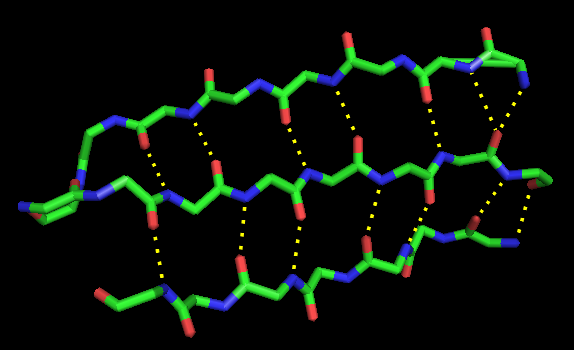 |
Рис. 7 карта посторенная для рассматриваемого бета-листа программой SheeP c параметром beta-sheets detector: Original STRIDE. |
Рис. 8 Водородные связи в пределах бета листа. Видно, что в центральной части листа нерегулярностей нет, на краю листа при переходе к участку нерегулярной структуры видна нерегулярность связей (кислород образует две водородные связи). |












