Описание белка
μ-опиоидные рецепторы (MOR) - класс опиоидных рецепторов, которые сильно сходны с энкефалинами и бета-эндорфином. Типичный агонист для μ-опиоидного рецептора - морфин, первичный психотропный алкалоид опиума.
Это ингибиторные рецепторы, сопряжённые с G-белком. Они активируют Gi-субъединицу, подавляя активность аденилатциклазы,
понижая уровень циклического аденозинмонофосфата.
MOR является промежуточным звеном в экстренных изменениях раздражимости нейронов, подавляя пресинаптическое выделение ГАМК.
Активация MOR ведет к различным эффектам дендритов, зависящих от агониста,
и может быть примером функционального отбора в μ-рецепторе.
Роль этих двух механизмов в патологии и физиологии еще предстоит прояснить.
Возможно, оба они могут учавствовать в развитии зависимости к опиоидам
и вызванными ими когнитивными проблемами.
Гидрофобное ядро
Для анализа было выбрано гидрофобное ядро, центром которого является остаток фенилаланина ([PHE]289:A), для удобства обозначенный как MyResidue. Поиск проводился вручную, так как на момент выполнения работы сервис анализа гидрофобных кластеров CluD[3] был недоступен (ссылку на скрипт можно найти в разделе "Скрипты").
Минимальное расстояние
Можно заметить, что чем сильнее мы удаляемся от MyResidue, тем большее количество атомов его окружает. Наибольшее количество атомов появляется в интервалах 3-4Å и 4-5Å. Однако даже на расстоянии в 7 ангстрем, максимальном из рассмотренных в работе, поверхность MyResidue местами остается открытой, поэтому выбор минимального расстояния, на котором атомы практически полностью покрывают остаток, можно сделать лишь с тем допущением, что наличие довольно больших "просветов" нас устраивает. Визуально можно определить, что разница между изображениями атомов, находящимися не более чем в 6Å и 7Å от MyResidue невелика, поэтому остановимся на расстоянии в 6Å. Итак, на расстоянии в 6 ангстрем от остатка окружающие атомы покрывают его поверхность так, что ее практически не видно.
Характерное расстояние
Опять же анализируя изображение апплета можно заметить, что основное количество связанных ковалентно атомов появляется на расстоянии 2-3 ангстрем, а наибольшее число атомов в общем - на расстоянии 3-5 ангстрем, исходя из чего можно сделать вывод, что характерное расстояние между соседними не связанными ковалентно атомами в белке находится в диапазоне 3-4 ангстрем.
Молекула воды
Для того, чтобы молекула воды поместилась между двумя соседними атомами, необходимо, чтобы сумма радиусов двух этих атомов, сложенная с диаметром молекулы воды, была меньше характерного расстояния. Учитывая все вышеприведенные рассуждения, можно сделать вывод о том, что это невозможно. Даже при самом благоприятном раскладе (все атомы - кислороды с ван-дер-ваальсовым радиусом, равным 1.4Å) эта сумма равна 5.6, что уже привышает характериное расстояние.
Авторы:
Денисов Кирилл описал белок и процесс выделения контактов, а также собрал информацию о лигандах и перевел страницу на английский язык.
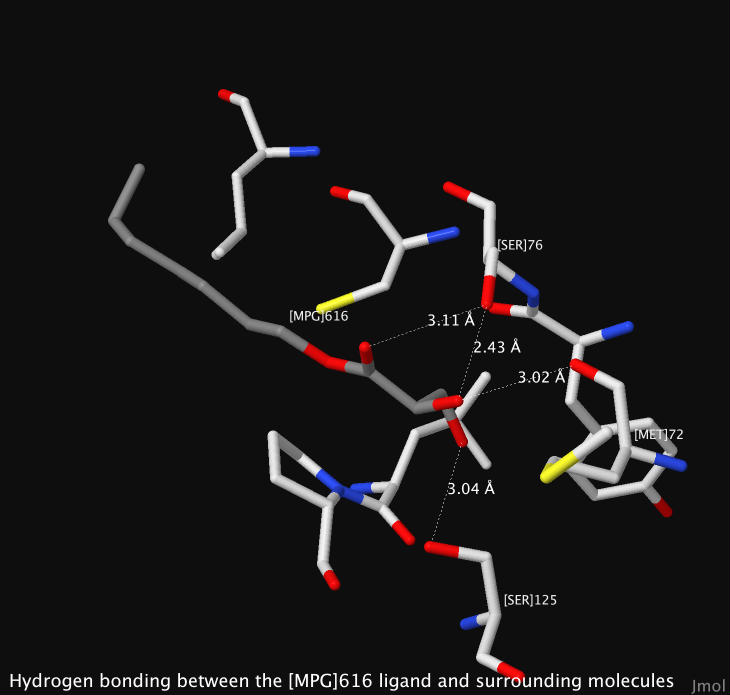
Коркунова Елизавета выделила и предоставила информацию о лиганд-белковых и белок-белковых взаимодействиях, описала и проанализировала параметры гидрофобного ядра и написала соответствующие скрипты для их визуализации. Создала CSS/HTML код страницы.