База данных STRING
C помощью базы STRING были определены белки, которые взаимодействуют с белком pheA бактерии Bifidobacterium adolescentis штамм ATCC 15703. Граф белковых взаимодействий представлен на рис. 1.
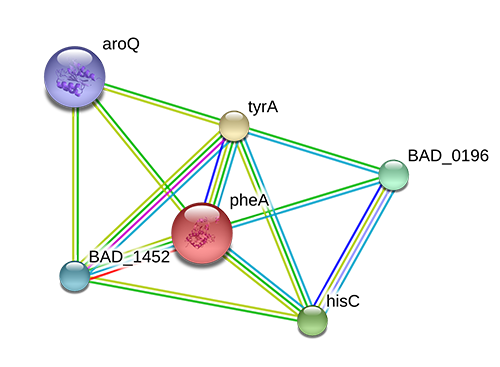
Информацию о белках, с которыми взаимодействует pheA можно найти в таблице 1.
| Ген или локус | Название на английском | Название на русском | Длина белка | Функция | EC реакции | Метаболические пути |
| pheA | chorismate mutase | Хоризмат мутаза | 326 aa | Превращение хоризмата в префенат | 5.4.99.5 | Синтез фенилаланина, тирозина и триптофана. Синтез вторичных метаболитов. Синтез антибиотиков. |
| tyrA | prephenate dehydrogenase | Префенат дегидрогеназа | 346 aa | Превращениt префената в 4-гидрокси-фенилпируват | 1.3.1.12 | Синтез фенилаланина, тирозина и триптофана. Синтез вторичных метаболитов.Синтез антибиотиков. Синтез новобиоцина. |
| hisC | histidinol-phosphate aminotransferase | Гистидинол-фосфат аминотрансфераза | 391 aa | Перенос аминогруппы с L-гистидинолфосфата на 2-оксоглутарат | 2.6.1.9 | Метаболизм аминокислот (гистидин, тирозина, фенилаланина). Синтез фенилаланина, тирозина и триптофана. Синтез вторичных метаболитов. Синтез антибиотиков. Синтез новобиоцина. Синтез алкалоидов. |
| BAD_0196 | aspartate aminotransferase | Аспартат аминотрансфераза | 396 aa | Перенос α-аминогруппы между аспартатом и глутаматом | 2.6.1.1 | Метаболизм аминокислот (аланина, аспартата, и глутамата, цистеина и метионина, аргинина и пролина, тирозина, фенилаланина). Синтез фенилаланина, тирозина и триптофана. Синтез вторичных метаболитов. Синтез антибиотиков. Синтез новобиоцина. Синтез алкалоидов. Фиксация углерода у фотосинтезирующих организмов. |
| BAD_1452 | chorismate mutase | Хоризмат мутаза | 137 aa | Превращение хоризмата в префенат | 5.4.99.5 | Синтез фенилаланина, тирозина и триптофана. Синтез вторичных метаболитов. Синтез антибиотиков. |
| aroQ | 3-dehydroquinate dehydratase | 3-дегидрокуинат дегидратаза | 149 aa | превращение 3-дегидрокуината в 3-дегидрошикимата | 4.2.1.10 | Синтез фенилаланина, тирозина и триптофана. Синтез вторичных метаболитов. Синтез антибиотиков |
Как видно из таблицы 1, все найденные белки участвуют в синтезе фенилаланина, тирозина и триптофана, а также других метаболитов. Продукт реакции, катализируемой pheA, является субстратом для ракции, катализируемой tyrA, то есть эти ферменты осуществляют последовательные реакции. Примечательно, что ген из локуса BAD_1452 выполняет ту же функцию, что и фермент pheA. Найденные ферменты не образуют друг с другом известные ферментативные комплексы.
Была получена информация о геномном окружении гена белка pheA. Дерево с точностью до филлума можно найти на рис. 2. Развёрнутую версию можно скачать по следующей ссылке
_0.png)
Как видно на рис. 2 гены tyrA и hisC встречаются вместе с pheA у Gammaproteobacteria, Betaproteobacteria, deltaepsilon subdivisions, Firmicutes, а также в единичных случаях у Elusmicrobia и Thermodesulfovibro yellowstonnii. Внутри Gammaproteobacteria pheA (в этом можно убедиться, если взглянуть на полноразмерное дерево) локализован либо с tyrA, либо с hisC, либо с двумя этими генами. Это может указывать на оперонную организацию генов. С этой гипотезой согласуется то, что tyrA и pheA катализируют последовательные реакции, а все три фермента участвуют в синтезе фенилаланина, тирозина и триптофана.
Среди таксонов deltaepsilon subdivision (3 случая) и Betaproteobacteria (Accumulibacter phosphatis) обнаружены сшивки гена pheA c геном из локуса BAD_1452, обладающего той же активностью. Это может указывать на доменную организацию фермента хоризмат мутазы у данных организмов.
Был получен график (с точностью до филлума) совместной встречаемости гомологов генов (рис. 3).
_3.png)
Согласно полученным данным, все шесть гомологов белка pheA и белков его ближайшего окружения встречаются в одиннадцати таксонах. В остальных случаях встречаемость гомологов белка BAD_1452 ниже, чем гомологов других белков.
Последовательность гомологов белка pheA менее консервативна, чем последовательности гомологов белков hisC и aroQ, что может указывать на меньшую вовлеченность pheA в центральные процессы метаболизма. В противном случае значительные изменения в последовательности могли бы привести к серьёзным нарушениям жизнедеятельности организма.