Мембранные белки
Для работы был выбран белок-транспортёр двухвалентных ионов металлов (divalent metal ion transporter – DMT) бактерии Staphylococcus capitis. Была составлена репрезентативная выборка гомологов белка DMT транспортёра с помощью blastp в базе данных refseq_protein. Значение идентичности находок было не ниже 39%. Из белков бактерий (из поиска исключили филумы Proteobacteria, Firmicutes, Actinobacteria) было выбрано 10 последовательностей, из белков эукариот – 11, из белков архей – 8. Белковые последовательности скачали, объединили в один файл и выровняли с помощью сервиса Muscle. Выравнивание можно скачать по следующей ссылке. Выравнивание открыли в программе JalView (окраска ClustalX, белок DMT находится в первой строчке).
С белком DMT ассоциировали его трёхмерную структуру. Основываясь на ассоциированной структуре, была добавлена аннотация положения трансмембранных спиралей (буква M в строке TM_REAL в проекте с выравнивание соответствует трансмембранному участку).
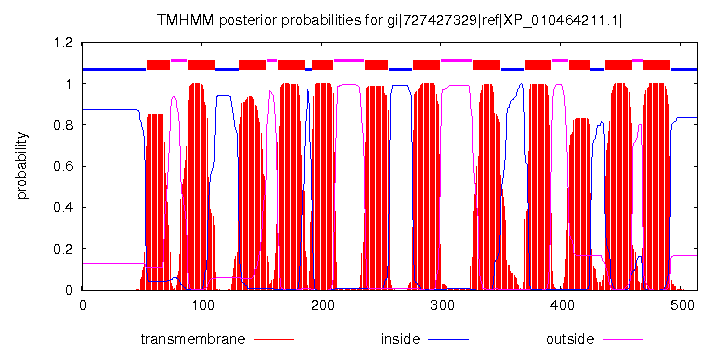
С помощью сервиса TMHMM была получена аннотация трансмембранных участков для одного из гомологов белка DMT. Был выбран гомолог Nramp4-подобного транспортёра из Camelina sativa. Аннотация была добавлена в строку TM_PREDICTED (буква M соответствует трансмембранному участку). Соответственно 55-74, 89-11, 132-154, 164-186, 193-210, 237-256, 277-299, 327-349, 370-392, 407-424, 437-459, 469-491 аминокислотные остатки были предсказаны как трансмембранные. График предсказания участков белка, полученный с помощью TMHMM, изображён на рис. 1. Проект с выравниванием, содержащим аннотацию, можно скачать по следующей ссылке.
Выравнивание окрасили согласно гидрофобности-гидрофильности аминокислотных остатков (Hydrophobicity, Above Identity Threshold 40%: красный цвет соответствует гидрофобным остаткам, синий – гидрофильным). Данное окрашивание было применено и для трёхмерной структуры белка (рис. 2).
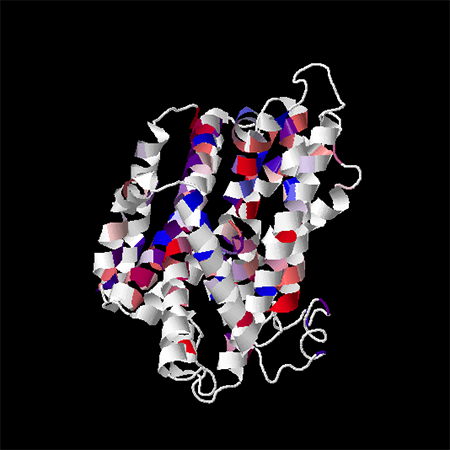
Как видно в проекте с выравниванием, трансмембранные участки белка достаточно консервативны. В них встречаются как гидрофобные, так гидрофильные остатки примерно в равном соотношении. Чаще всего среди гидрофобных аминокислот встречаются валин, изолейцин, лейцин. Гидрофильных – серин и глицин.
Участки выравнивания сохраняют свою консервативность только внутри трансмембранных доменов.
В состав трансмембранных участков входят такие заряженные аминокислоты как аспарагиновая кислота, глутаминовая кислота. Это может быть связано с функцией данного белка транспортировать положительные ионы через мембрану. В этом случае отрицательные аминокислоты необходимы для того, что бы стабилизировать комплекс иона с белком. Примечательно, что также встречаются и положительно заряженные аминокислоты, такие как аргинин. Возможно, они служат для сохранения нейтрального заряда белка в то время, когда он не связывает ионы металла.
Можно сказать TMHMM делает предсказание трансмембранных элементов с высокой степенью достоверности. Однако, точные границы трансмембранных доменов, как правило, не совпадают для предсказания и результатов анализа реальной структуры.
Одна трансмембранная альфа-спираль не была отнесена к таковым при использовании TMHMM. Возможно, это связано с её небольшим размером. Однако в PDB файле (получен с помощью OPM), изображающем положение белка в мембране, данная спираль погружена параллельно мембране, а выравнивание говорит о высокой степени консервативности данного участка. Это данные согласуются с тем, что этот участок можно отнести к трансмембранным.