|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
 |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
Исследование ДНК-белкового комплекса 1I3J Краткое описание структуры в файле 1I3J.pdb
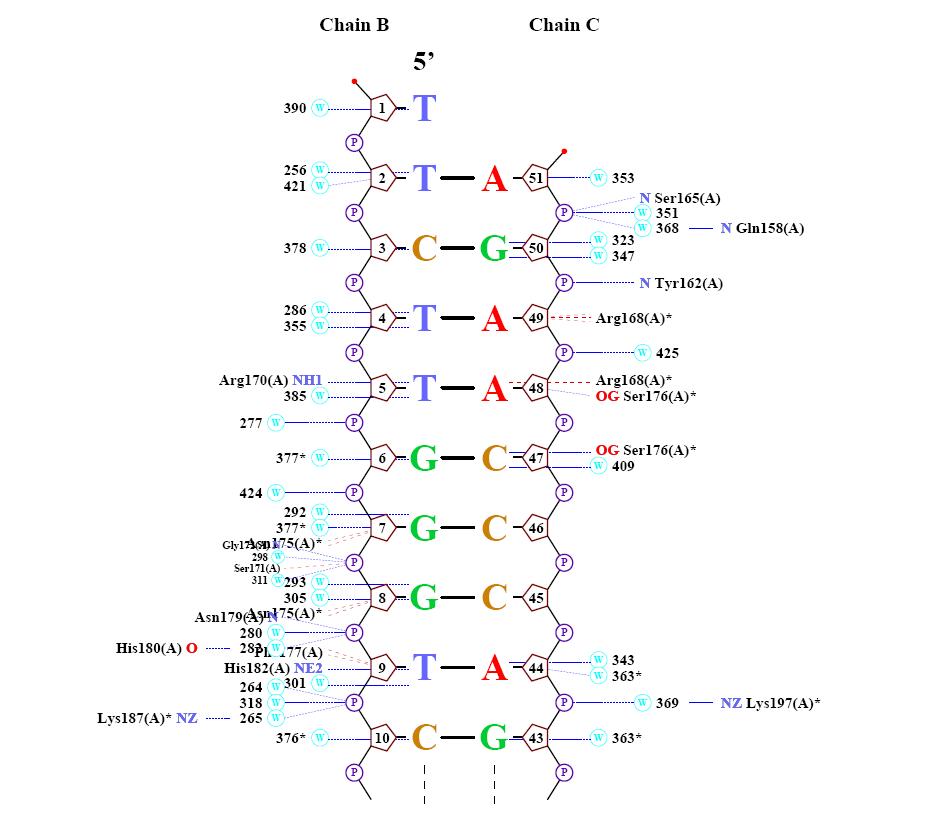
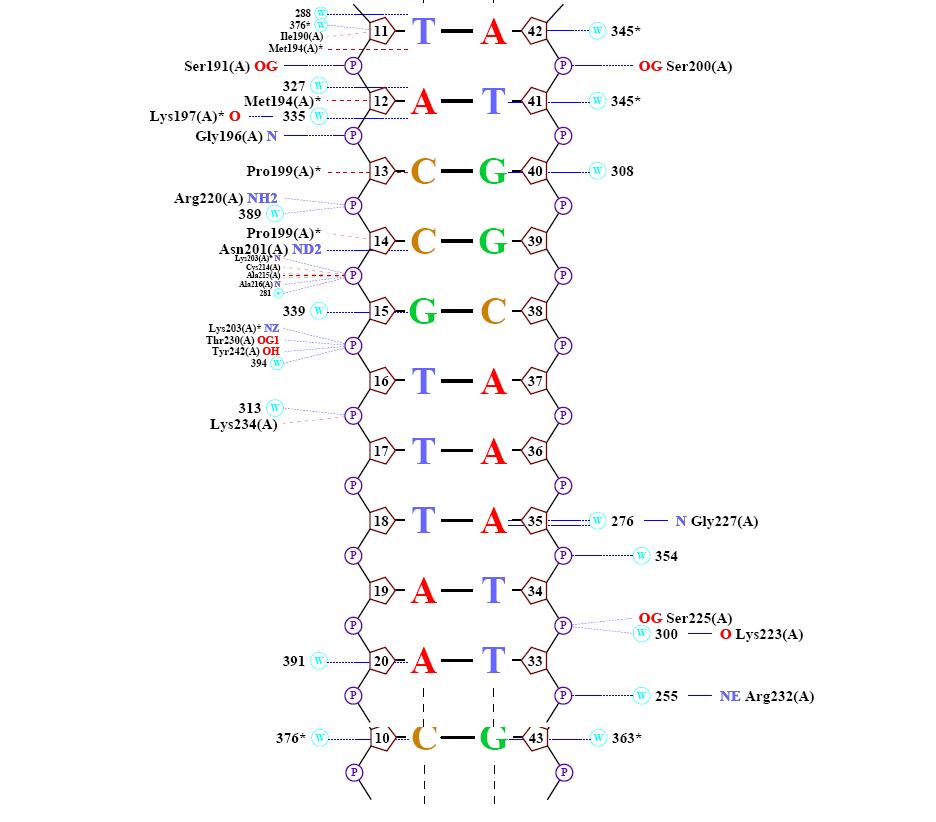
1) это двухчепочечная ДНК, сосотоящая из цепи В и С, каждая цепочка состоит из 21 нуклеотидов. 2) это интрон связанная эндонуклеаза, днк связывающий домен, это цепь А состоит из 116 а.о. Оргаинизм содержащий комплекс: Энтробактерия фаг т4
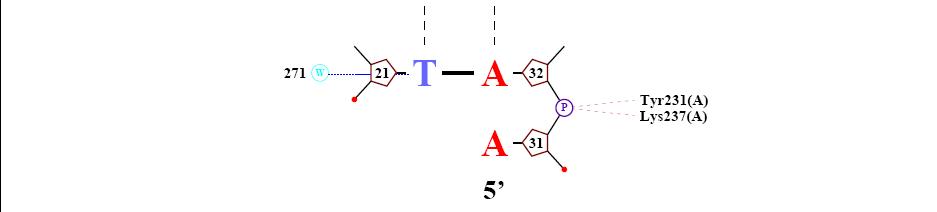
цепь С [51] 3' - AGAACCCAGATGGCAAATTAA- 5' [31] где 1 и 21 - номера первого и последнего нуклеотида. Функции белка, структура которого представлена в файле 1I3J.pdb Исследование структуры ДНК Самый "кривой нуклеотид" - цитозин 10 из цепи B. Исследование природы ДНК-белковых контактов Считаем полярными атомы кислорода и азота, а неполярными – атомы углерода, фосфора и серы. Полярным контактом ситуацию, в которой расстояние между полярным атомом белка и полярным атомом ДНК меньше 3.5Å. Аналогично, неполярным контактом будем считать пару неполярных атомов на расстоянии меньше 4.5Å.
Для получения данной схемы была использована команда: nucplot 1I3J_old.pdb
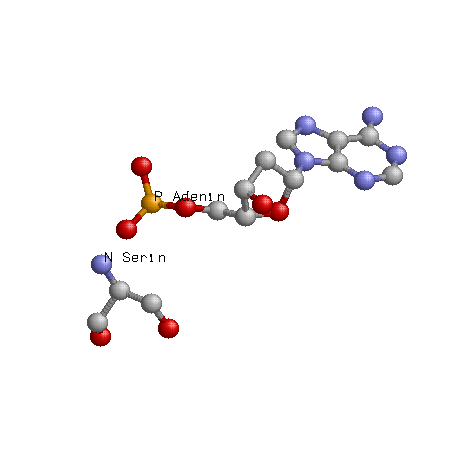
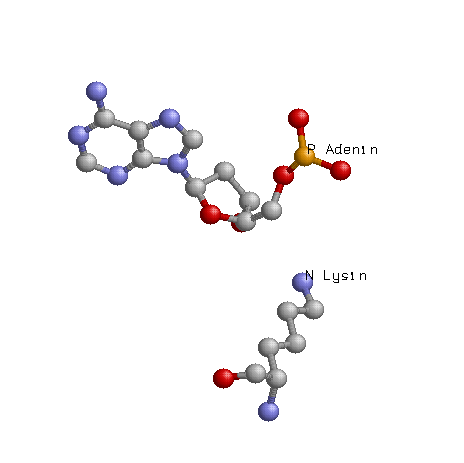
Можно сделать вывод о том, что "кривизна" нуклеотида и его связь с белком не находятся между собой в прямой зависмости, т.е. не факт, что если конформация нуклеотида сильно изменена, то это напрямую зависит от контактов его с белком. Например, самый "кривой", который мы рассчитали по торсионным углам являлся с10(таблица), согласно nucplot он не имеет ни 1 контакта с белком. Таким образом, можно сделать вывод о том, что контакты с белком являются лишь одним из факторов, влияющих на конформацию нуклеотидов. Возможный(е) распознающий(е) контакт(ы) Рассматривая данные полученные с помощью nucplot можно заметить, что количество взаимодействий между контакт между белком и дезоксирибозой - 7, между белком и остатками фосфорной кислоты - 22, между атомами азотистых оснований и атомами ДНК - 9. Следовательно, очевидно, хорошим кандидатом на роль распознающего контакта аминокислотного остатка с нуклеотидом будет взаимодействие между белком и остатками фосфорной кислоты, так как их больше почти в 3 раза чем остальных взаимодействий белка с ДНК. Взаимодействие Аденина 51 с азотом Серина 165: Взаимодействие Аденина 44 с азотом (в радикале) Лизина 197:
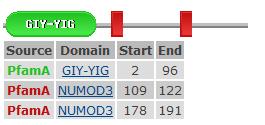
GIY-YIG: Во время процесса вырезания нуклеотида у e.coli, находка повреждения ДНК и обработка достигается действием uvrA, uvrB, и uvrC . Белки UvrC содержат 4 области: центральная область, которая взаимодействует с UvrB (область Uvr), спираль шпильки-спиральная (HhH) область, важна для 5 главных разрезов ДНК при повреждении и еще из 2 областей неизвестной функции. NUMOD3: Это короткий спиральный мотив неизвестной функции, найденной в интрон связывающей нуклеазе 2, которая связана с процессом возвращения интрона.
|
|
||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
© Замараев Алексей |
|
||||||||||||||||||||||||||||