Практикум 2: A- и В- формы ДНК. Структура РНК
Задание 1
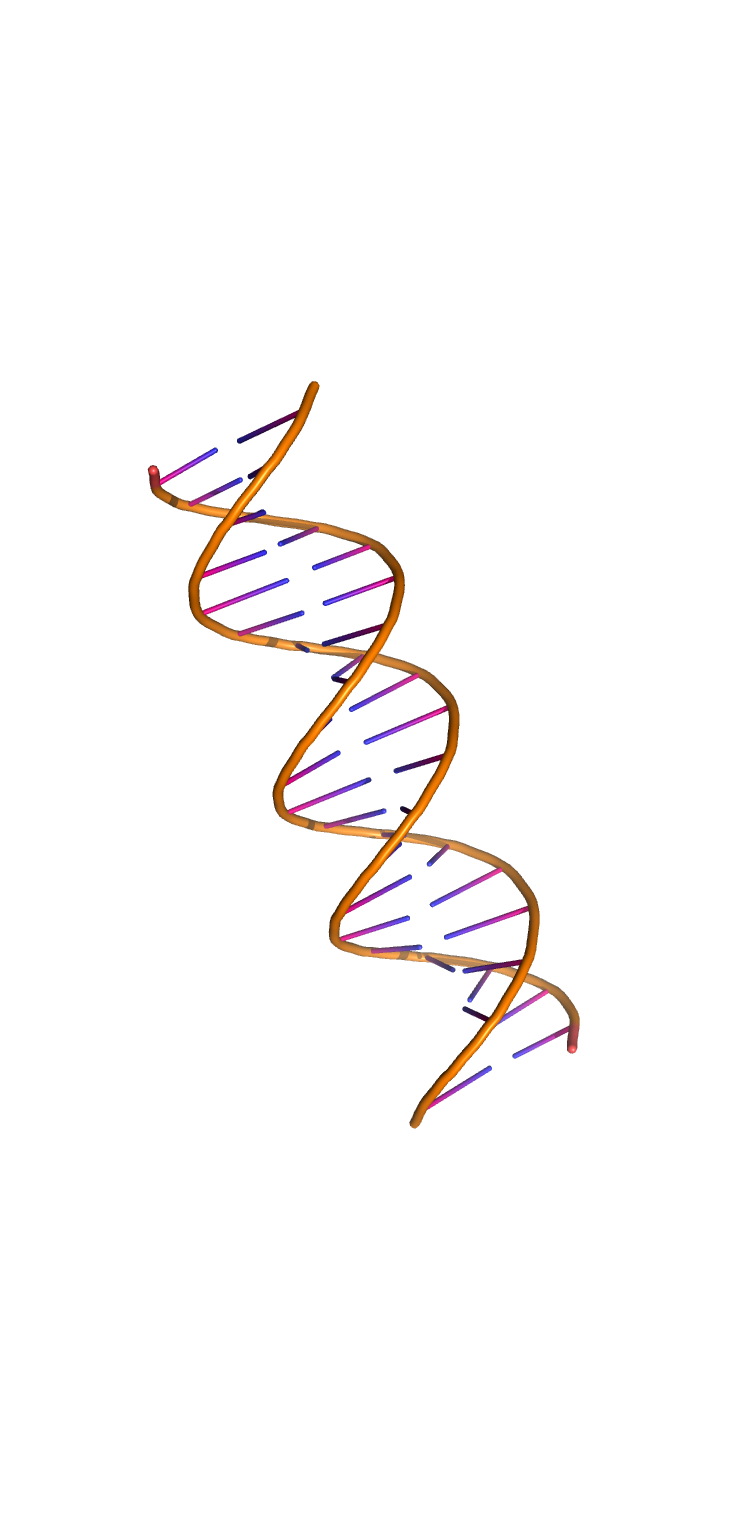
С помощью программы fiber пакета 3DNA были построены A-, B- и Z-формы дуплекса ДНК, последовательность одной из нитей которого представляет собой 5 раз повторенную последовательность "agct".
Использовались следующие команды:
fiber -a -seq=AGCT -rep=5 agct-a.pdbfiber -b -seq=AGCT -rep=5 agct-b.pdbfiber -z -seq=AGCT -rep=5 agct-z.pdb
Были получены следующие структуры: A-форма, B-форма, Z-форма.


Отдельные цепи
Этот белок принадлежит Homo sapiens, но был синтезирован Escherichia coli.
ID в базе Uniprot: P56817.
Отвечает за протеолитическую обработку амилоидного предшественника белка (APP), разрезая его на N-конце последовательности A-бета пептида. Это приводит к образованию и высвобождению бета-расщепленного растворимого APP и C-концевого фрагмента, который затем высвобождается гамма-секретазой. Также расщепляет CHL1.
Забавно, но за время выполнения моей работы, оказывается ID успел переименоваться. Был Q9ULS1, а стал P56817.
В цепи нет ни мутаций, ни модифицированных аминокислотных остатков.

Малые молекулы
В записи PDB есть лишь один лиганд: 4-(cyclohexylamino)-1-(3-fluorophenyl)-8-[3-(propan-2-yloxy)benzyl]-1,3,8-triazaspiro[4.5]dec-3-en-2-one - 4QA

Практикум 4: Взаимодействия
Контакты
- В структуре данного белка (4ZPE) можно найти следующие типы взаимодействий:
- Водородная связь, затрагивающая атомы остова белка (см. рис. 4)
- Водородная связь, затрагивающая атомы боковых радикалов аминокислот (см. рис. 5)
- Солевой мостик (см. рис. 6)
- Дисульфидная связь (см. рис. 7)
- Стекинг (см. рис. 8)





Практикум 5: Взаимодействия
Реакция
Этот фермент катализирует расщепление последовательности Glu-Val-Asn-Leu-|-Asp-Ala-Glu-Phe в шведском варианте амилоидного предшественника белка, связанного с болезнью Альцгеймера. Он является основной "бета-секретазой", ответственной за расщепление бета-амилоидного предшественника белка с образованием амилоидогенного бета-пептида, который участвует в патогенезе болезни Альцгеймера. Фермент относится к семейству пептидаз A1 и обладает широкой специфичностью к эндопептидазам.
Каталитическая активность белка EC 3.4.23.46 в базе EXPAZY
Каталитически активный центр
В состав каталитического центра данного фермента входят два аспартата — ASP-32 и ASP-228. Напрямую между друг другом у них связи нет.
В окружении до 5 ангстрем каталитического центра аминокислоты связаны в основном водородными связями (не считая пептидные).
