MALTOPORIN MALTOTRIOSE COMPLEX
Введение
Мальтопорин — это мембранный белок, обеспечивающий транспорт мальтозы и малтьтодекестринов
через внешнюю мембрану ГРАМ-отрицательных бактерий, таких как Escherichia coli .
Он играет ключевую роль в транспорте длинных мальтоолигосахаридов, так как они не способны проникнуть внутрь
мембраны через неспецифические порины.[1] Канал белка сформирован тремя антипараллельными бета-бочками (Рис.1).
Сахара проникают внутрь по «жирному скату», то есть благодаря гидрофобным взаимодействиям с ароматическими
остатками внутренней обкладки канала.[1,2] Этот белок также известен как LamB, так как он используется
бактериофагом лямбда в качестве опознавательного рецептора.[3]
Uniport ID: P02943
Количество аминокислотных остатков: 1263
Цепи: A, B ,C (рис 1)
Лиганды
В нашем белке ионы магния связываются с остатками аспарагиновой кислоты (см. лиганд-белковые взаимодействия). Интересно, что в некоторых транспортерах, например, OmpF канале E.coli, связывание магния с остатками аспарагиновой кислоты увеличивает сродство антибиотика энрофлоксацина к каналу: благодаря изменению заряда энрофлоксацин пересекает область сужения канала в предпочтительной ориентации.[4] При более высокой концентрации мальтотриозы у E. Coli возможен её транспорт не только через LamB, но и через другие каналы - OmpC и OmpF.[5]
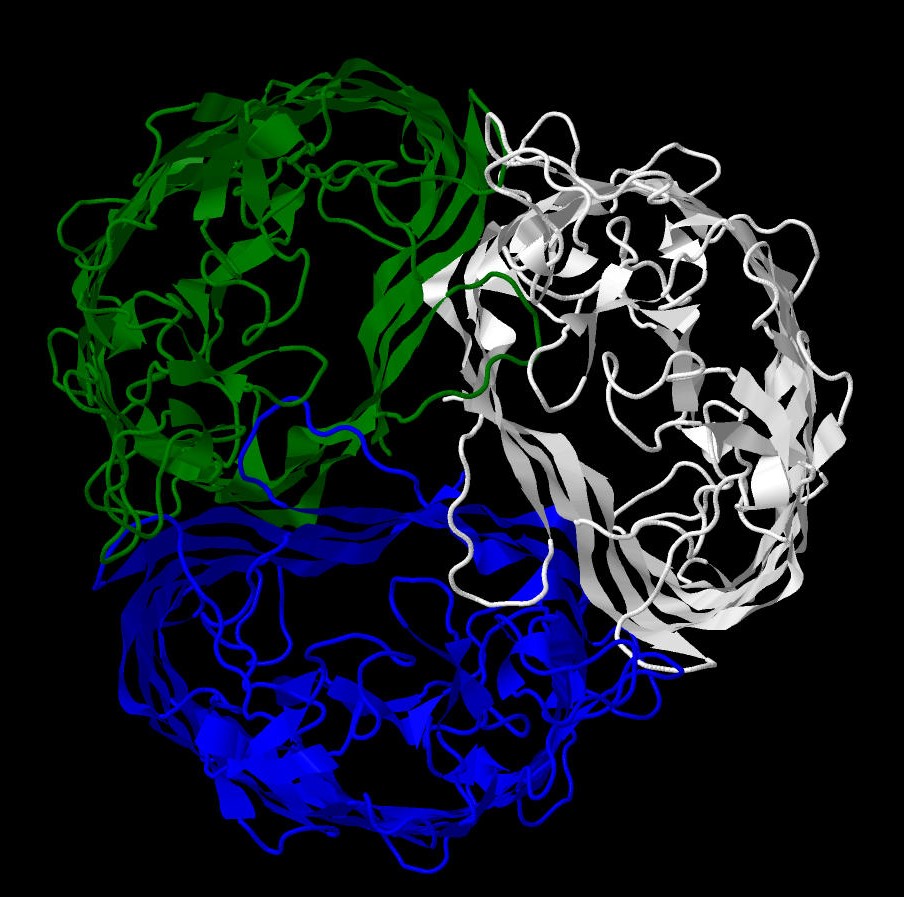
Рис. 1 Структура белка, раскраска по цепям

Mg
Ион магния
Название(IUPAC): Magnesium(2+)
Брутто-формула: Mg(2+)
Молярная масса: 24.305 g/mol
PubChem ID:888
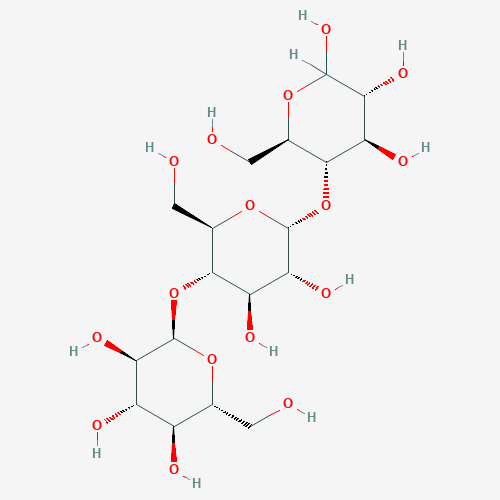
GLC
Мальтотриоза
Название(IUPAC): Alpha-D-gluco-hexopyranosyl-(1->4)-alpha-D-gluco-hexopyranosyl-(1->4)-D-gluco-hexopyranose
Брутто-формула: C18H32O16
Молярная масса: 504.438 g/mol
PubChem ID:439586
Белок-белковые взаимодействия
Гидрофобные взаимодействия
Гидрофобные взаимодействия в молекуле мальтопорина выполняют две важные функции: во-первых, гидрофобная обкладка каналов, как был сказано выше, посредством взаимодействий с олигосахаридами
позволяет им пассивно проникать в клетку; во-вторых, гидрофобные ядра белка
формируют его четвертичную структуру. В этом ключе нами было рассмотрено гидрофобное ядро на границе субъединиц A и B исследуемой
структуры, сформированное вокруг аминокислотного остатка триптофана (TRP101:A). В апплете отражен сам остаток и его атомное
окружение на расстоянии от 1 до 7 ангстрем. Как можно видеть, на расстоянии до 3 ангстрем располагаются только атомы,
ковалентно связанные с остатком (всего 5 крупных атомов); на расстоянии до 4 ангстрем расположено уже 30 крупных атомов
окружения. Из этих данных следует, что в рассматриваемой молекуле среднее межатомное расстояние составляет порядка 3.5
ангстрем.
Дисульфидные мостики
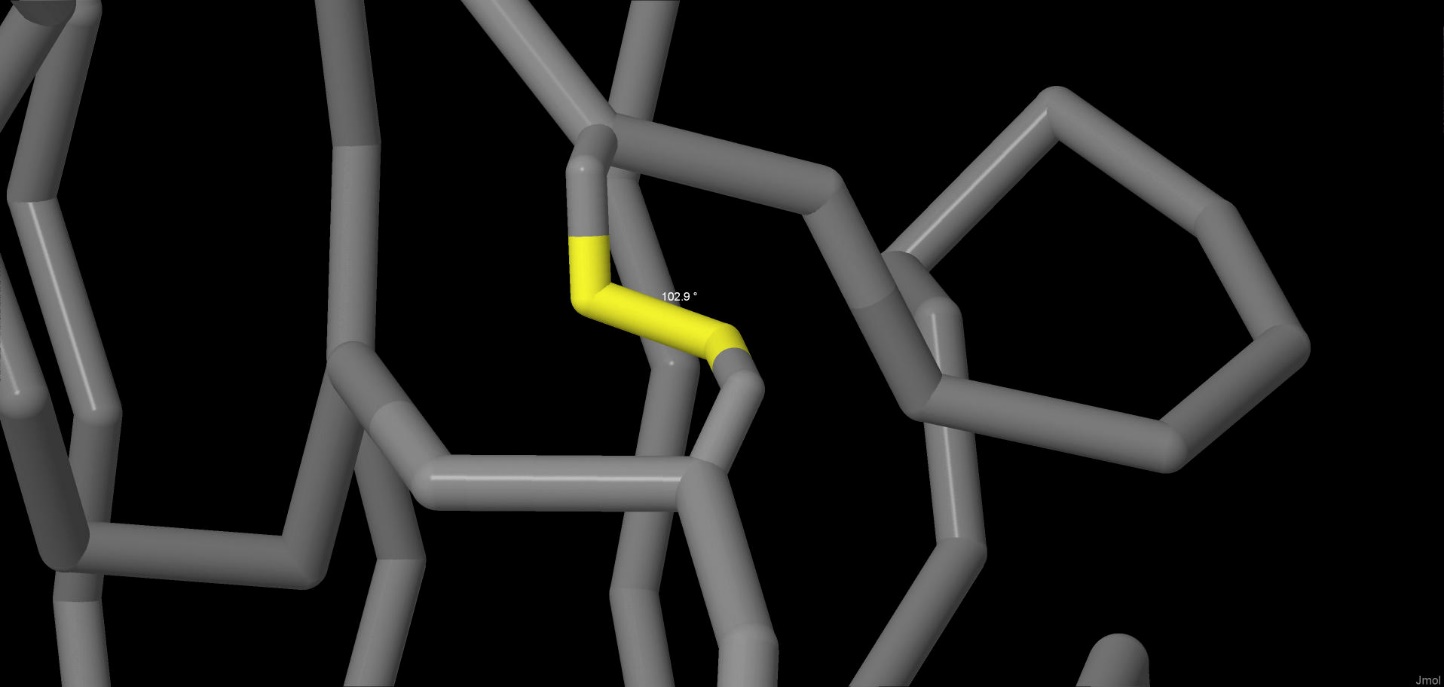
Дисульфидные мостики в молекуле белка являются единственными ковалентными связями, стабилизирующими третичную структуру.
Связь образуется между двумя аминокислотными остатками цистеина. В рассмотренной нами молекуле имеется по одному дисульфидному
мостику в каждой из 3 субъединиц. Представлена связь между 22 и 38 аминокислотными остатками цистеина субъединицы A (CYS022:A
– CYS038:A). Измерены параметры связи: торсионный угол составляет 102.9 градусов, длина связи – 2.03 ангстрема.
Водородные связи также участвуют в формировании пространственной структуры белка, вторичной или третичной. В молекуле мальтопорина сеть водородных связей формирует так называемый бета-бочонок в каждой субъединице, характерный для поринов. Нам же было интересно рассмотреть водородные связи, не участвующие напрямую в формировании вторичной структуры. Так, нами были рассмотрены для примера 2 водородные связи, формирующие из отрезков первичной структуры субъединицы A белка петли. Связь между кислородом карбонильной группы ASN383 и азотом аминогруппы ASN387 имеет длину 2.61 ангстрем и образует угол N-O-C, равный 148.3 градуса.(Рис.2) Аналогичные характеристики связи между кислородом THR025 и азотом ALA028 составили 2.9 ангстрем и 145.4 градуса.(Рис.3) Идеальным углом считается угол 150.0 градусов, длина водородной связи в норме составляет от 2.6 до 3.3 ангстрем.
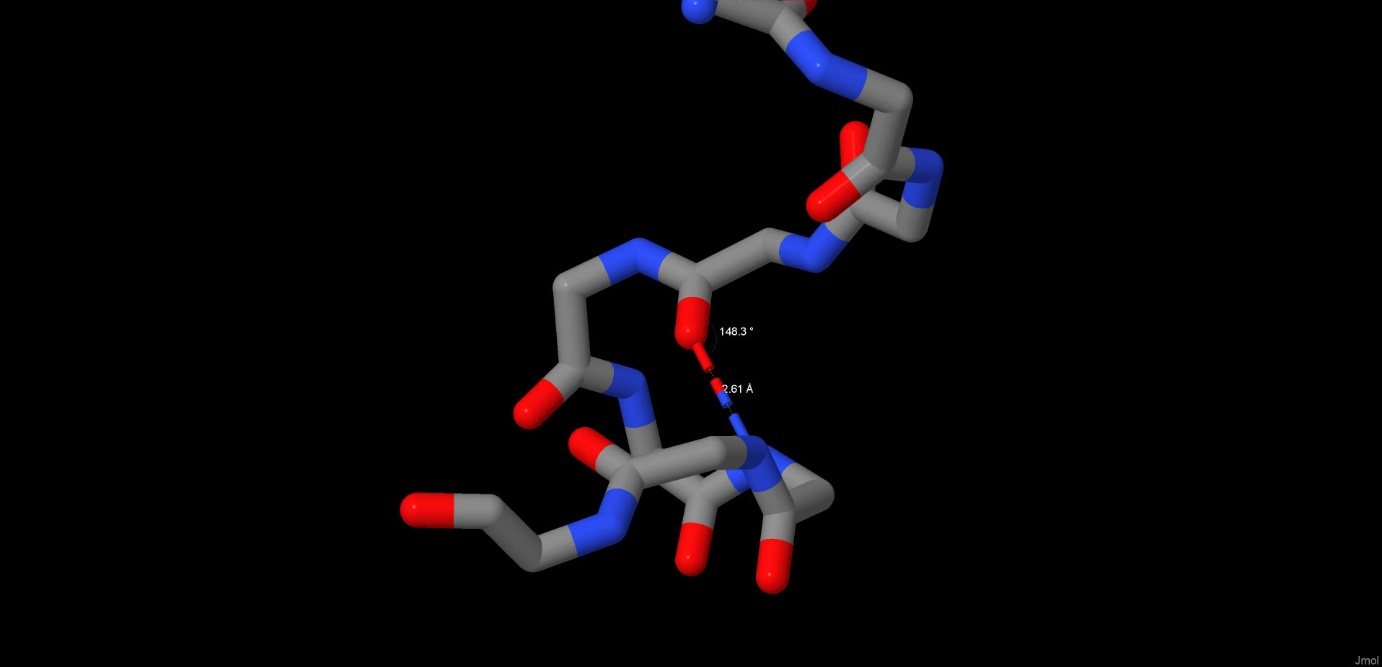
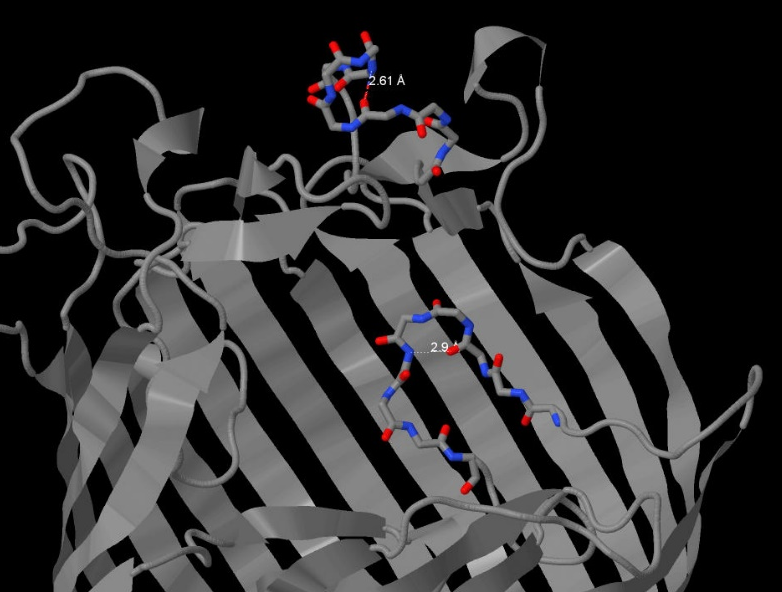
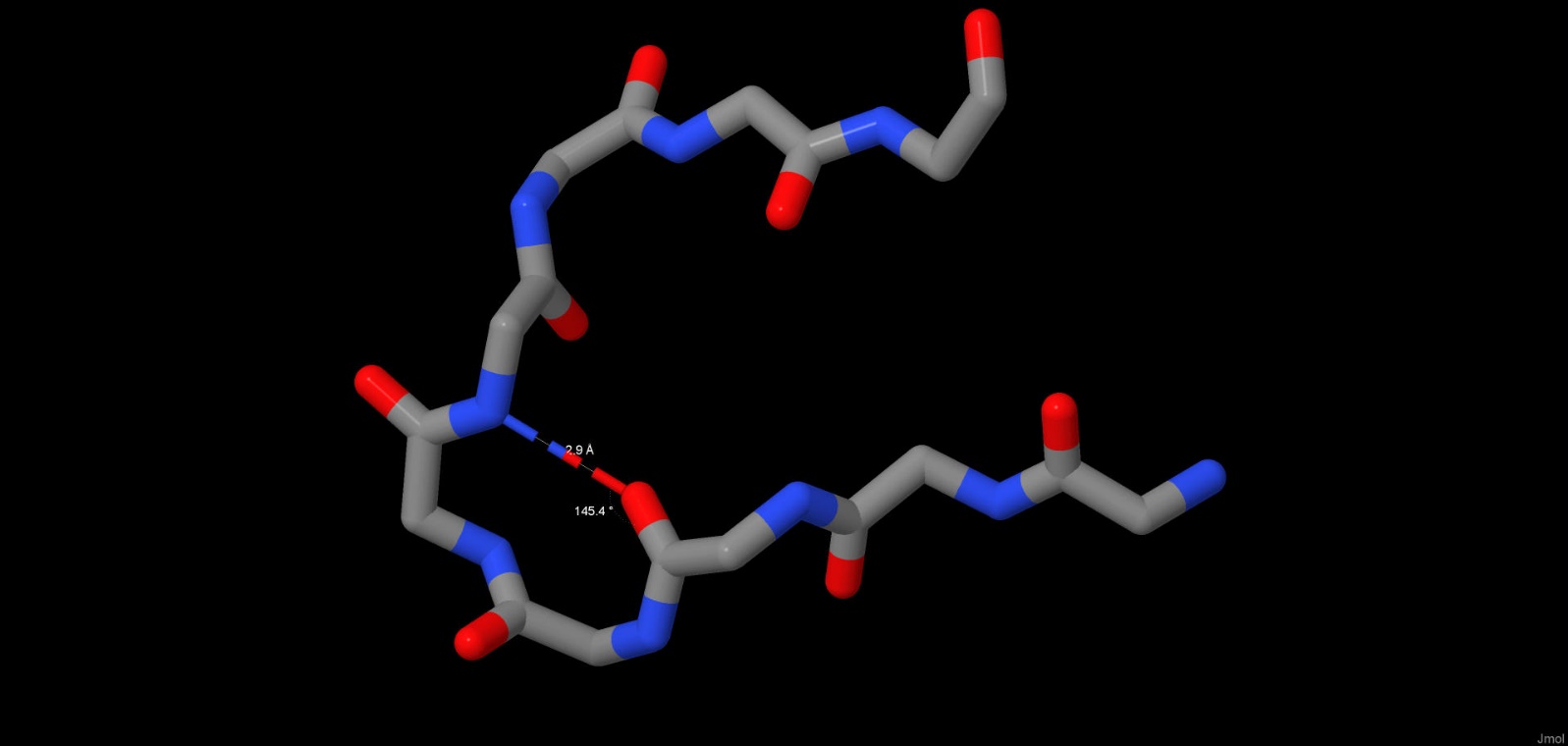
Рис.2 Водородные связи
Бета-бочка
Рис.3 Водородные связи
Солевые взаимодействия имеют электрическую природу. В белке они возникают между заряженными частями молекулы, такими как карбоксильная группа, заряженная при средних и высоких значениях pH отрицательно, и аминогруппа, при средних и низких pH заряженная положительно. Такие взаимодействия существуют при любых углах и в широком диапазоне расстояний, однако играют роль в формировании структуры лишь на расстоянии до 5 ангстрем. В таблице представлены длины некоторых электростатических взаимодействий в молекуле мальтопорина. Солевые мостики участвуют в формировании третичной и четвертичной структур. Представленный на картинке аминокислотный остаток 082ARG:B взаимодействует с а.к.о. той же цепи 043GLU:B и а.к.о. другой цепи 073ASP:C.
Поиск солевых мостиков проводился вручную среди заряженных положительно и отрицательно остатков, ионизированные радикалы которых были ориентированы определенным образом по отношению друг к другу. Заметим, что расстояние было измерено между заряженными функциональными группами, заряд которых распределен равномерно между атомами вследствие делокализации, поэтому указывать атомы, между которыми непосредственно измерено расстояние, не имеет смысла.
| # | A.a.r.(-) | A.a.r.(+) | Длина связи, ангстрем |
|---|---|---|---|
| 1 | 043GLU | 082ARG | 3.90 |
| 2 | 073ASP:C | 082ARG | 2.70 |
| 3 | 116ASP | 033ARG | 4.02 |
| 4 | 075GLU:C | 106LYS | 3.59 |
| 5 | 039GLU | 039LYS | 5.07 |
| 6 | 061ASP | 045LYS | 2.66 |
| 7 | 188GLU | 110HIS | 3.30 |
| 8 | 218GLU | 110HIS | 3.30 |
| 9 | 002ASP | 004HIS | 4.84 |
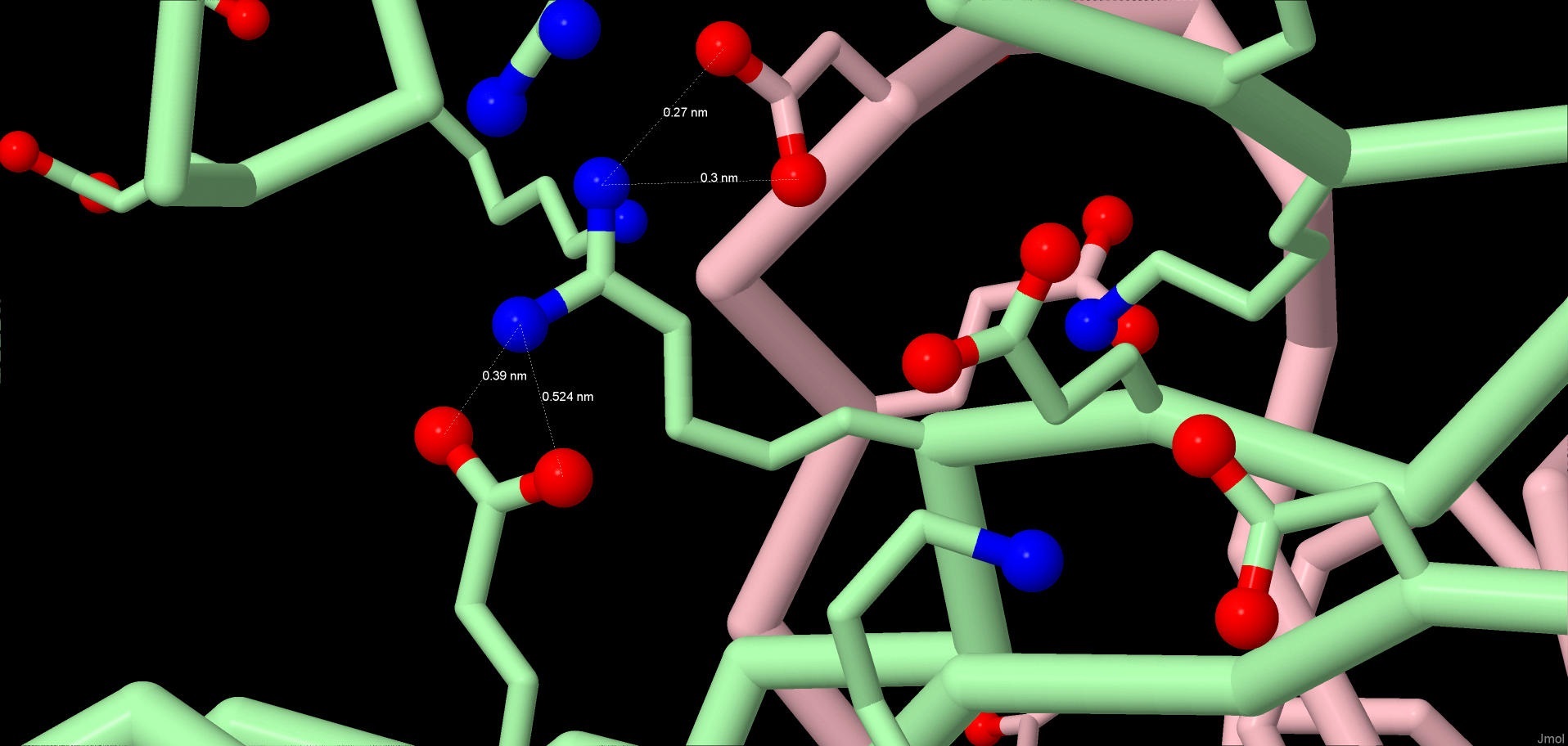
Рис.4 Солевые мостики
Лиганд-белковые взаимодействия
Связи между ионом металла и белком
Ион магния связан с молекулой белка 6 связями (их медианная длина 2,54 ангстрем для одного из резонансных состояний): он взаимодействует с каждым из двух атомов кислорода, принадлежащих радикалам трех молекул аспарагиновой кислоты (из цепей A, B, C) (Таблица 1).Данные связи уже были изображены на скачанной нами из PDB структуры. Однако можно было бы предположить их существование, не видя на модели линий, связывающих атомы. Известно, что расстояния между атомами в молекулах лежат в пределах от 1 до 4 ангстрем.[6]. С помощью команды restrict(4, 422:C), 4 – это максимально возможное расстояние в А, а 422:C – атом магния найдем атомы, лежащие на расстоянии меньшем или равным 4 A от атома магния. Получим карбоксильные группы 3 остатков аспарагиновой кислоты. Положительно заряженный ион Mg 2+ удерживается в молекуле белка отрицательно заряженными карбоксильными группами.
| # | Имена атомов | Длина связи, ангстрем | |
|---|---|---|---|
| Связи, образуемые с [ASP]78:C | |||
| 1 | [MG]422:A - [ASP]78:A.OD1 | 2,52 | |
| 2 | [MG]422:A - [ASP]78:A.OD2 | 3,03 | |
| Связи, образуемые с [ASP]78:B | |||
| 4 | [MG]422:A - [ASP]78:B.OD1 | 2,2 | |
| 5 | [MG]422:A - [ASP]78:B.OD2 | 2,56 | |
| Связи, образуемые с [ASP]78:C | |||
| 6 | [MG]422:A - [ASP]78:C.OD1 | 2,24 | |
| 7 | [MG]422:A - [ASP]78:C.OD2 | 2,84 | |
| Медиана | 2,54 | ||
| # | Имена атомов | Длина связи, ангстрем | |
|---|---|---|---|
| Связи, образуемые [GLC]431:A с атомами самого белка | |||
| 1 | [GLC]431:A.O2 [ARG]33:A.NH1 | 2.62 | |
| 2 | [GLC]431:A.O2 [ARG]33:A.NH2 | 3.09 | |
| 3 | [GLC]431:A.O2 [HIS]113:A.ND1 | 3.1 | |
| 4 | [GLC]431:A.O3 [ASP]111:A.OD21 | 3.3 | |
| 5 | [GLC]431:A.O3 [HIS]113:A.ND1 | 2.68 | |
| 6 | [GLC]431:A.O4 [ASP]111:A.OD11 | 3.32 | |
| 7 | [GLC]431:A.O4 [ASP]111:A.OD2 | 3.39 | |
| Связи, образуемые [GLC]432:A с атомами самого белка | |||
| 8 | [GLC]432:A.O2 [ARG]8:A.NH1 | 3.49 | |
| 9 | [GLC]432:A.O2 [ARG]8:A.NH2 | 3.38 | |
| 10 | [GLC]432:A.O2 [ASP]116:A.OD2 | 2.78 | |
| 11 | [GLC]432:A.O3 [ARG]8:A.NH1 | 3.43 | |
| 12 | [GLC]432:A.O3 [ARG]33:A.NH2 | 2.3 | |
| 13 | [GLC]432:A.O4 [TYR]118:A.OH | 3.49 | |
| 14 | [GLC]432:A.O6 [GLU]43:A.OE1 | 3.08 | |
| 15 | [GLC]432:A.O6 [GLU]43:A.OE2 | 2.52 | |
| 16 | [GLC]432:A.O6 [ARG]109:A.NH2 | 2.93 | |
| Связи, образуемые [GLC]433:A с атомами самого белка | |||
| 17 | [GLC]433:A.O3 [ASP]116:A.OD2 | 3.13 | |
| 18 | [GLC]433:A.O6 [ARG]109:A.NH2 | 3.16 | |
| Связи внутри молекулы мальтотриозы | |||
| 19 | [GLC]431:A.O2 [GLC]432:A.O3 | 2.99 | |
| 20 | [GLC]432:A.O5 [GLC]433:A.O6 | 3.29 | |
| Медиана | 3.115 | ||
Водородные связи между атомами молекулы мальтотриозы и белка можно посмотреть не с помощью команды calculate hbonds, а в PDB, перейдя по ссылке «Ligand interaction» в блоке «Small Molecules».
Длины водородных связей были измерены с помощью команды measure. Действительно, медианное значение длины связи приближается к идеальному 3.04 ангстрем[7]. Заметим, что те же водородные связи мы могли бы найти вручную, воспользовавшись командой within. Например, задав верхнюю границу водородной связи как 3.5 ангстрем. Результат выполнения select within(3.5, 431:A), где 431:A – глюкоза, выглядел бы так:
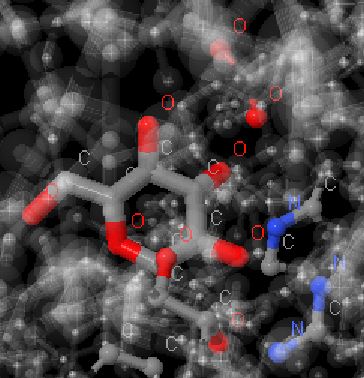
Рис.5. Результат выполнения select within(3.5, 431:A)
Мы видим те же атомы, которые образуют водородные связи по PDB (см.апплет).
Зайцева Елизавета: скрипты и описание белок-белковых взаимодействий
Птицына Елена: скрипты и описание лиганд-белковых взимодействий, скрипт с лигандами
Анна Паго: поиск информации о белке, введение и описание лигандов, размещение на странице, перевод
Скрипты:
Источники:
1. https://www.ncbi.nlm.nih.gov/pubmed/8805519
2. https://www.sigmaaldrich.com/catalog/papers/12003940
3. https://jnanobiotechnology.biomedcentral.com/articles/10.1186/1477-3155-3-3
4. Raj Singh P. et al. Antibiotic permeation across the OmpF channel: modulation of the affinity site in the presence of magnesium //The Journal of Physical Chemistry B. – 2012. – Т. 116. – №. 15. – С. 4433-4438.
5. Лихачева Н.А., Синеокий С.П. Фаговые рецепторы Escherichia coli. Неосновные порины и белки, участвующие в специфическом транспорте как фаговые рецепторы // Молекуляр. генетика, микробиология и вирусология. – 1989. – № 12. – С. 3–12.
6. Ландау Л.Д., Китайгородский А.И. Физика для всех: Молекулы \\6-е изд., стер - Москва: Наука. Главная редакция физико-математической литературы, 1984 – 208 с. [Элекронный ресурс] // Библиотека по физике.
URL: http://physiclib.ru/books/item/f00/s00/z0000016/st008..
7. Стайер Л. Биохимия: Пер. с англ.-М.: Мир, 1984.-Т. 1-232 с., ил.