Данный белок был получен из растения T. lanuginosa методом дифракции рентгеновских лучей.
 Tidestomia lanuginosa
Tidestomia lanuginosa
6HW1-белок относится к классу ферментов, катализирующих реакции гидролиза, т. е. расщепления органических соединений с присоединением по месту разрыва элементов молекулы воды (Н+ и ОН-).
[2]Общий вид реакции, катализируемой гидролазой, выглядит следующим образом: A–B + H2O → A–OH + B–H
Липаза - фермент,катализирующий гидролитическое расщепление триацилглицеридов до глицерина и жирных кислот. Представляет собой липопротеин с неорганическим кофактором. Липазы являются ферментами поверхностного действия и активизируются лишь находясь на поверхности суперсубстрата. Способность липаз функционировать на поверхности раздела липид-вода подразумевает, что фермент взаимодействует с полярными и неполярными молекулами.[10] У растений липазы содержатся преимущественно в семенах, плодах, клубнях, корневищах злаковых и в семенах крестоцветных.
.
 |
 |
 |
Название по IUPAC |
||
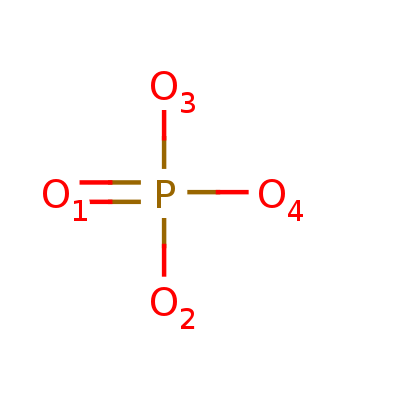
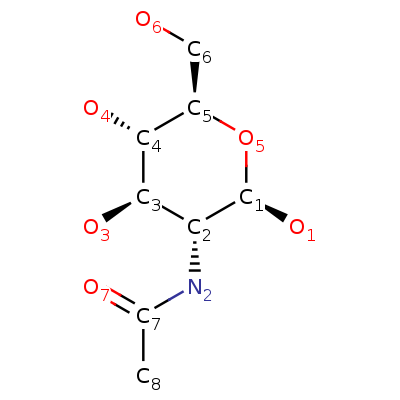
| Магний ион | Фосфат ион | N-[(2R,3R,4R,5S,6R)-2,4,5-тригидрокси-6-(гидроксиметил)оксан-3-ил]ацетамид |
Брутто-формула |
||
| Mg2+ | O4P-3 | C8H15NO6 |
Молярная масса |
||
| 24.305 а.е.м. | 94.97 а.е.м. | 221.209 а.е.м. |
PubChem CID |
||
| 888 | 1061 | 24139 |
Лиганд PO4 обнаружен только в одной из цепей белка, в отличие от остальных лигандов, расположенных симметрично.
Водородная связь - это форма взаимодействия между электроотрицательным атомом и атомом водорода, связанным с другим относительно элетроотрицательным атомом(обычно N,O,F).[4] Водородные связи могут быть межмолекулярными или внутримолекулярными. Большинство H-связей в белке находятся между основными группами N-H и C = O в альфа-спиралях или бета-листах. Такие связи мы находили в практикуме 1 по Jmol, поэтому в этот раз обратили внимание на водородную связь между [ARG]195:A и [SER]216:A. Расстояния между азотами [ARG]195:A.NE и [ARG]195:A.NH2 и кислородом [SER]216:A.O являются типичными для образования водородной связи (3.5А).[5] Этот случай интересен тем, что образуется двойная водородная связь между аминокислотными остатками.
Бензольные кольца двух остатков аминокислот ([PHE]7:A и [PHE]262:A) вступают в T-образное стэкинг взаимодействие. Они расположены перпендикулярно друг к другу.
Также притяжение образуется между фениалаланином и тирозином ([PHE]55:A и [TYR]53:A) Это подтверждается тем, что ароматические кольца параллельны друг другу и находятся на расстоянии ~3.5Å, что удовлетворяет теоретическому расстоянию для образования пи-сопряжения.
Солевые мостики[7] - одни из связей, поддерживающих третичную структуру белка. Это электростатическое взаимодействие, возникающее между катионом и анионом. Анионами могут выступать аспрагиновая и глутаминовая аминокислоты в белке, так как в боковом радикале у них есть карбоксильная группа. А катионами выступают такие аминокислоты, как аргинин, лизин и гистидин. Так как это электростатическое взаимодействие, то его сила зависит от расстояния между атомами, поэтому расстояние между атомами, которые участвуют в образовании солевого мостика, не должно превышать 4 ангстрем. Поэтому для выявления ионных пар в Jmol были выделены все пары O-N, отвечающие требованиям (O является частью Glu или Asp, N – His, Arg или Lys, a расстояние менее 4 ангстрем). Зеленым цветом покрашены атомы кислорода, а оранжевым – атомы азота. В апплете продемонстрированы эти связи и расстояние между ними.
Вклад гидрофобных взаимодействий[8] в формирование третичной и четвертичной структуры белка очень велик, так как они берут на себя более 75 % работы по созданию белковой глобулы. Чтобы реакция сворачивания белка в третичную структуру прошла самопроизвольно, энергия Гиббса должна быть меньше нуля. С увеличением энтропии уменьшается энергия Гиббса. При введении в воду неполярных элементов происходит упорядочивание молекул воды вблизи гидрофобных групп, она образует меньше водородных связей и ее энтропия уменьшается. Уменьшение площади поверхности между водой и гидрофобными структурами путем сближения гидрофобных структур и образования ими гидрофобных ядер повышает энтропию и вносит большой вклад в формирование третичной структуры. Поэтому в большинстве случаев белковая молекула имеет конформацию, при которой гидрофобные части находятся внутри молекулы, а гидрофильные группы контактируют с водой.
Для изучения гидрофобных взаимодействий в данном белке с помощью сайта сервиса CluD[9] были найдены гидрофобные ядра. Самые больше из них (содержащие больше 15 атомов) продемонстрированы в апплете. Далее в самом крупном ядре был выбран один из остатков Phe и прослежено окружение гидрофобного ядра атомами белка. На расстоянии 1Å не было обнаружено ни одного атома. На расстоянии 3Å вокруг остатка Phe находилось только 3 атома, тогда как на расстоянии 4Å их оказалось уже 32. Далее появилась закономерность, что при увеличении расстояния на 1Å, в окружении оказывалось примерно на 30 атомов больше.Можно утверждать, что уже на расстоянии 6Å от остатка Phe расположены атомы, которые полностью покрывают его поверхность, так как при дальнейшем отдалении атомы наслаиваются друг на друга, но гидрофобное ядро остаётся примерно таким же заметным.
Опираясь на полученные данные, можно сказать, что характерное расстояние между соседними не связанными ковалентно атомами в белке составляет примерно 4-5 ангстрем.
Чтобы молекула воды поместилась между двумя соседними атомами, среднее расстояние между ядрами атомов должно быть больше, чем сумма их радиусов и диаметра молекулы воды. Самые маленькие радиусы из всех атомов, которые входят в состав аминокислот, у кислорода и азота, поэтому расстояние между ними должно быть больше 5.75 Å. Но приведенные выше рассуждения показывают, что среднее расстояние примерно равно 4-5 Å, что значительно меньше 5.75 Å, поэтому молекула воды не сможет поместиться между соседними атомами.
Отрицательно заряженный фосфат-ион вступает во взаимодействие с положительно заряженным азотом аргинина. Расстояние между ионами, равное 3,31 ангстрем, позволяет нам судить о наличии ионного взаимодействия между ними. Это единственное взаимодействие, которое нам удалось найти, несмотря на все наши старания.
Соболь Анастасия написала скрипт и нашла информацию о стэкинг-взаимодействиях и водородных связях. Ей принадлежит web-дизайн страницы и поиск общей информации о белке.
Торосян Татевик работала над солевыми мостиками и гидрофобными взаимодействиями.
Никольская Арина изучала лиганды и дисульфидные мостики. Также написала программы по нахождению гидрофобных ядер.
Скачать скрипт: гидрофобные взаимодействия
Скачать скрипт: лиганды
Скачать скрипт: дисульфидные мостики
Скачать скрипт: стэкинг взаимодействия
Скачать скрипт: солевые мостики
Скачать скрипт: водородные связи
Скачать скрипт: взаимодействие лиганда с белком
[6] Спирин А.С. Молекулярная биология: Структура рибосомы и биоситез белка, стр.256