Общая характеристика
Запрос команды structure:
Количество водородных связей - 134
Количество α-спиралей - 9
Количество β-тяжей - 13
Количество реверсивных поворотов - 14
Вывод: белок относится к α+β белкам, так как в его структуре нерегулярно чередуются α-спирали и β-листы.
Исследование элементов вторичной структуры
Для исследования выбраны элементы вторичной структуры:
- Самая длинная α-спираль 108-124:A
- β-поворот, в которой полипептидная связь разворачивается на 180° 73-78:A
- Самая длинная пара соседних антипараллельных β-тяжей 129-135:A, 169-175:A
К сожалению, я не нашел достаточно большие участки параллельных β-тяжей, потому взял их из белка 1BS2
- Самая длинная пара соседних параллельных β-тяжей 144 - 148:A, 182 - 186:A (1BS2)
1. Исследование cамой длинной α-спирали
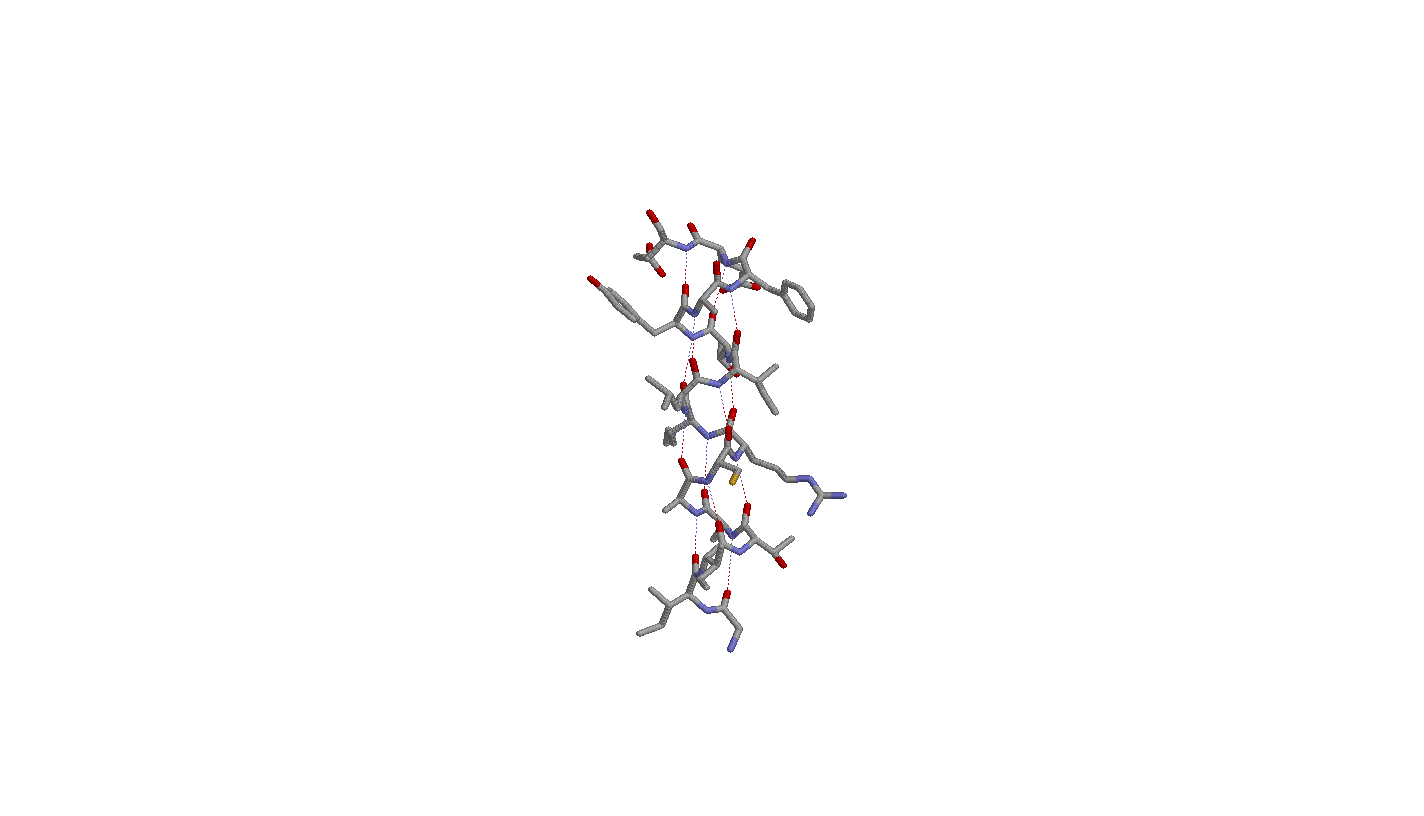
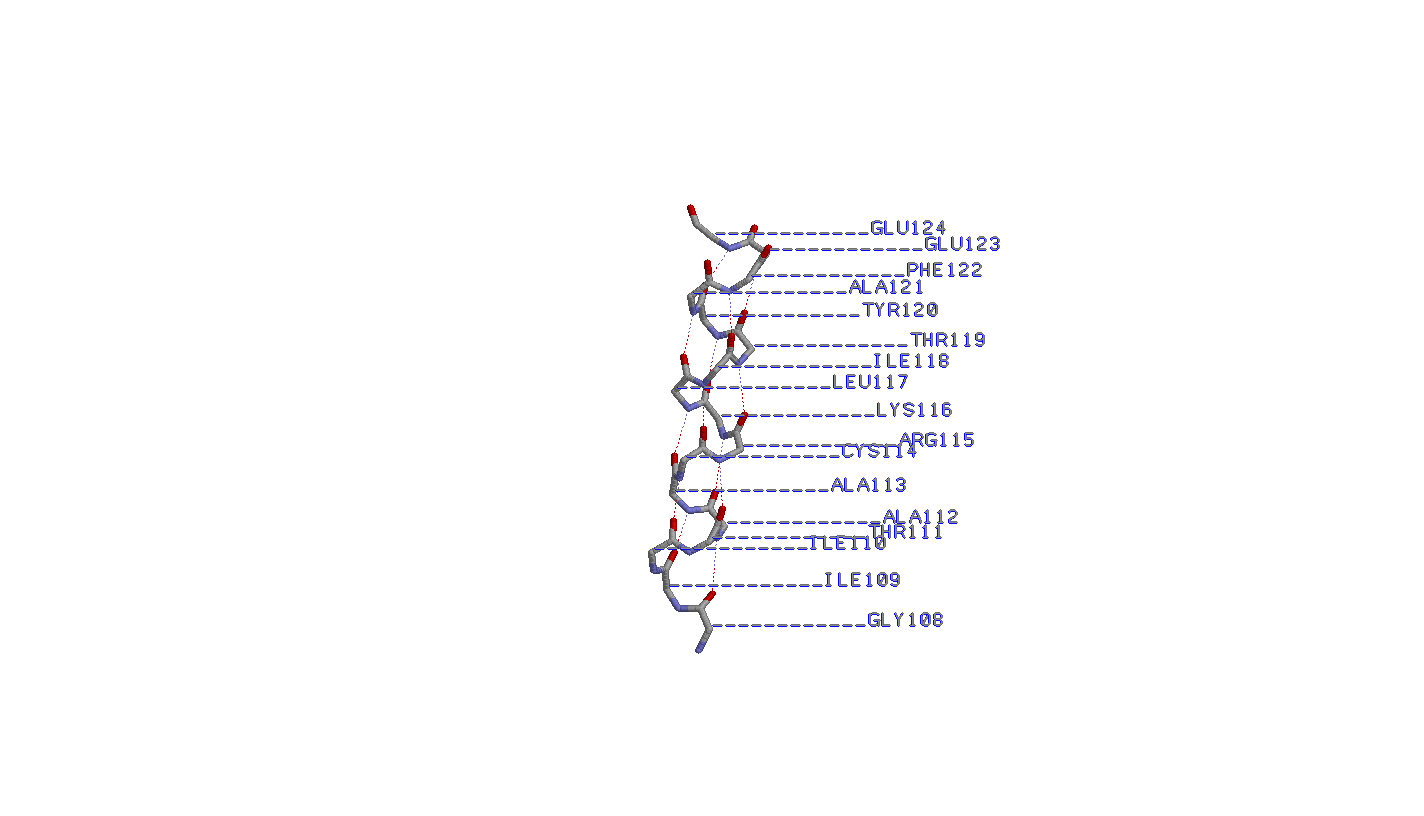
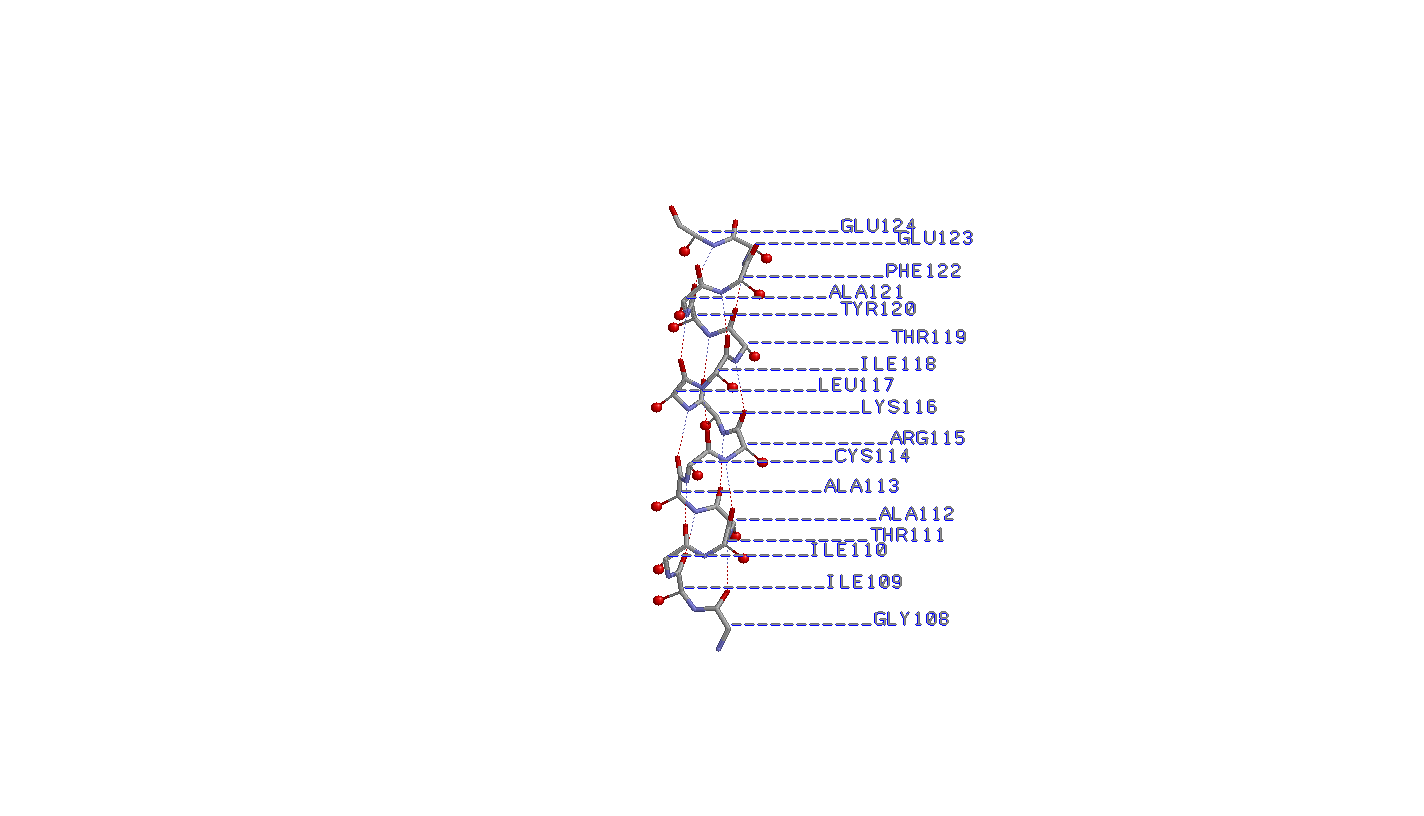
Паттерн водородных связей Н(i,i+4). Водородная связь между кислородом карбоксигруппы i-ого и азотом аминогруппы i+4-ого остатков (считая от N-конца)
2. Исследование соседних антипараллельных β-тяжей
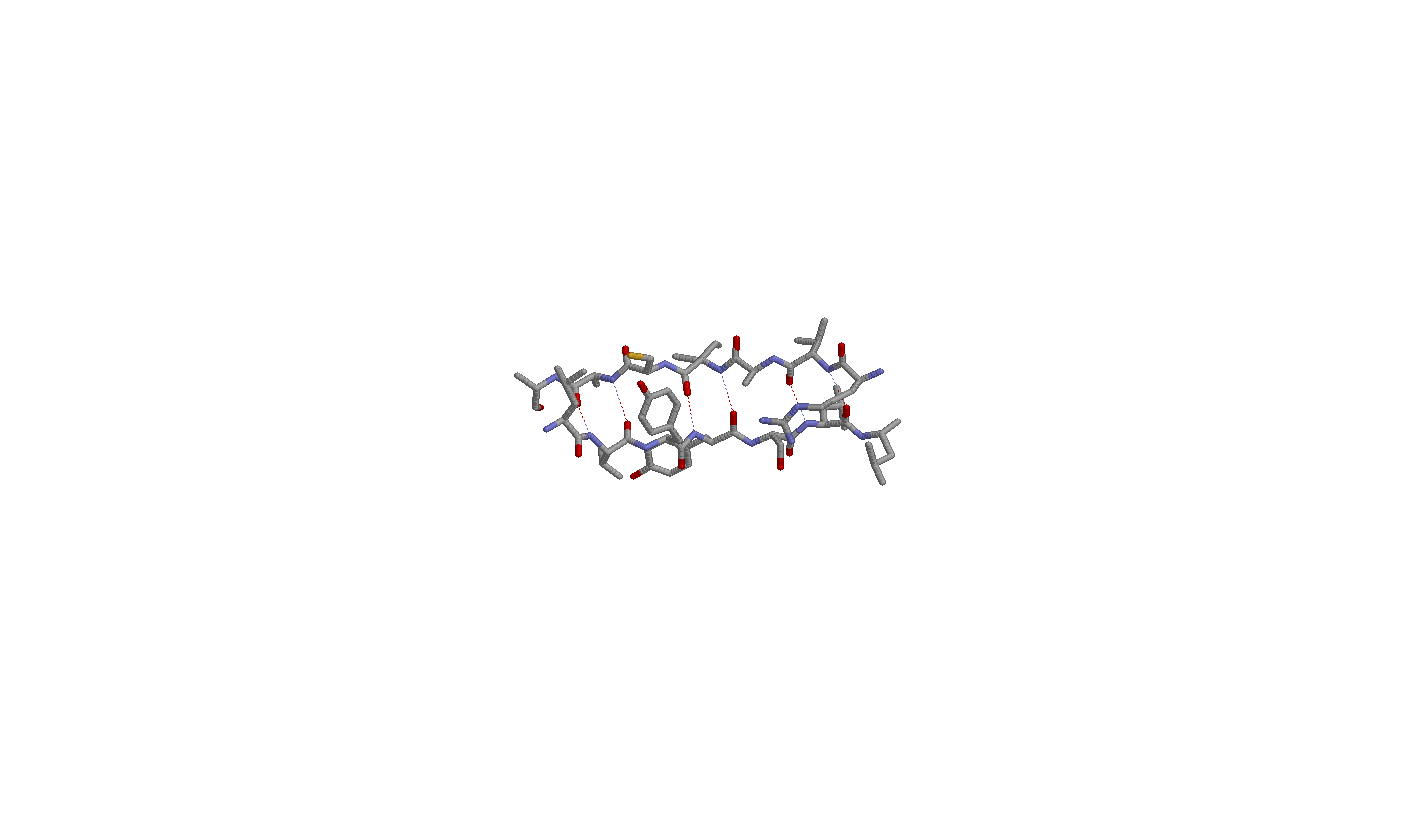
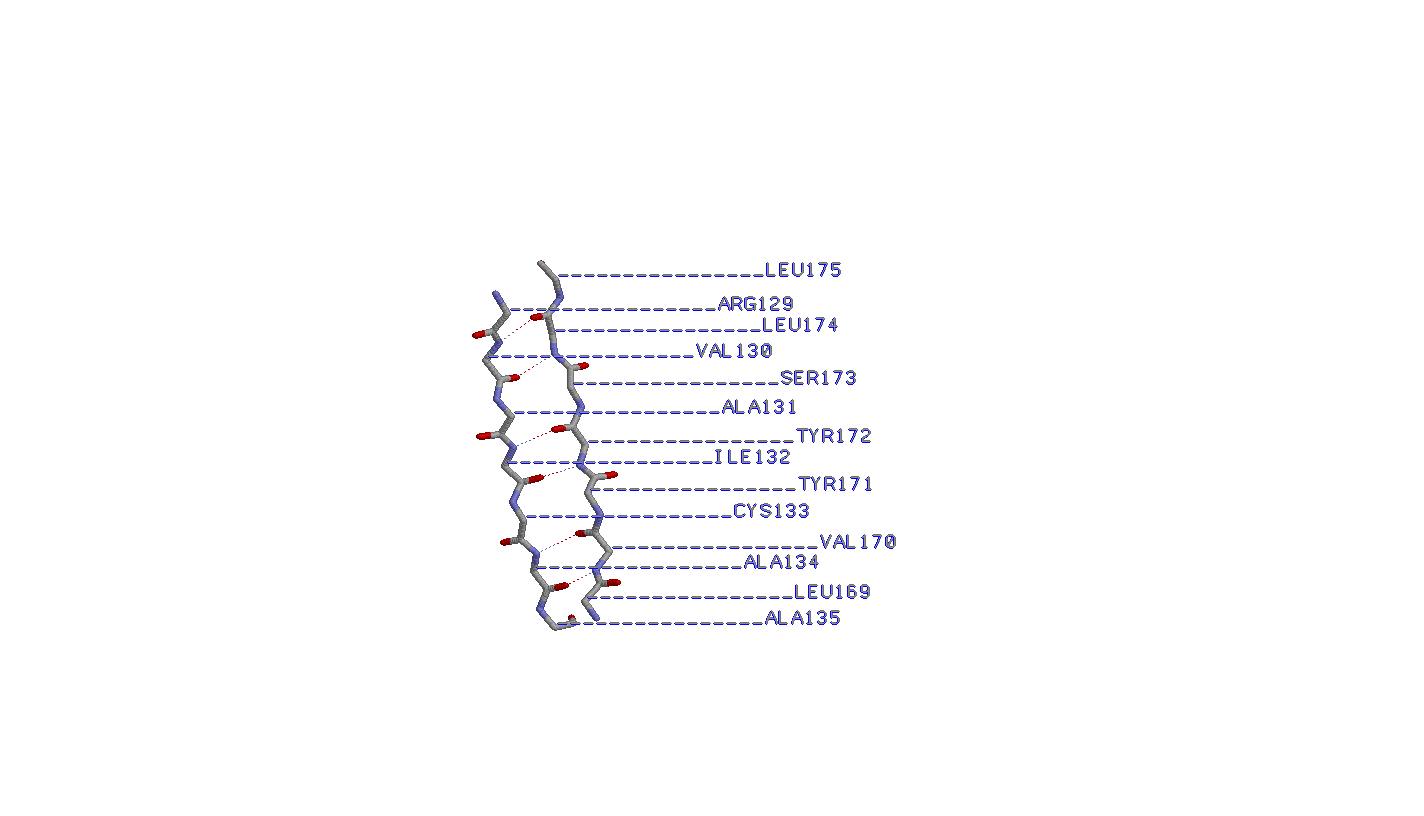
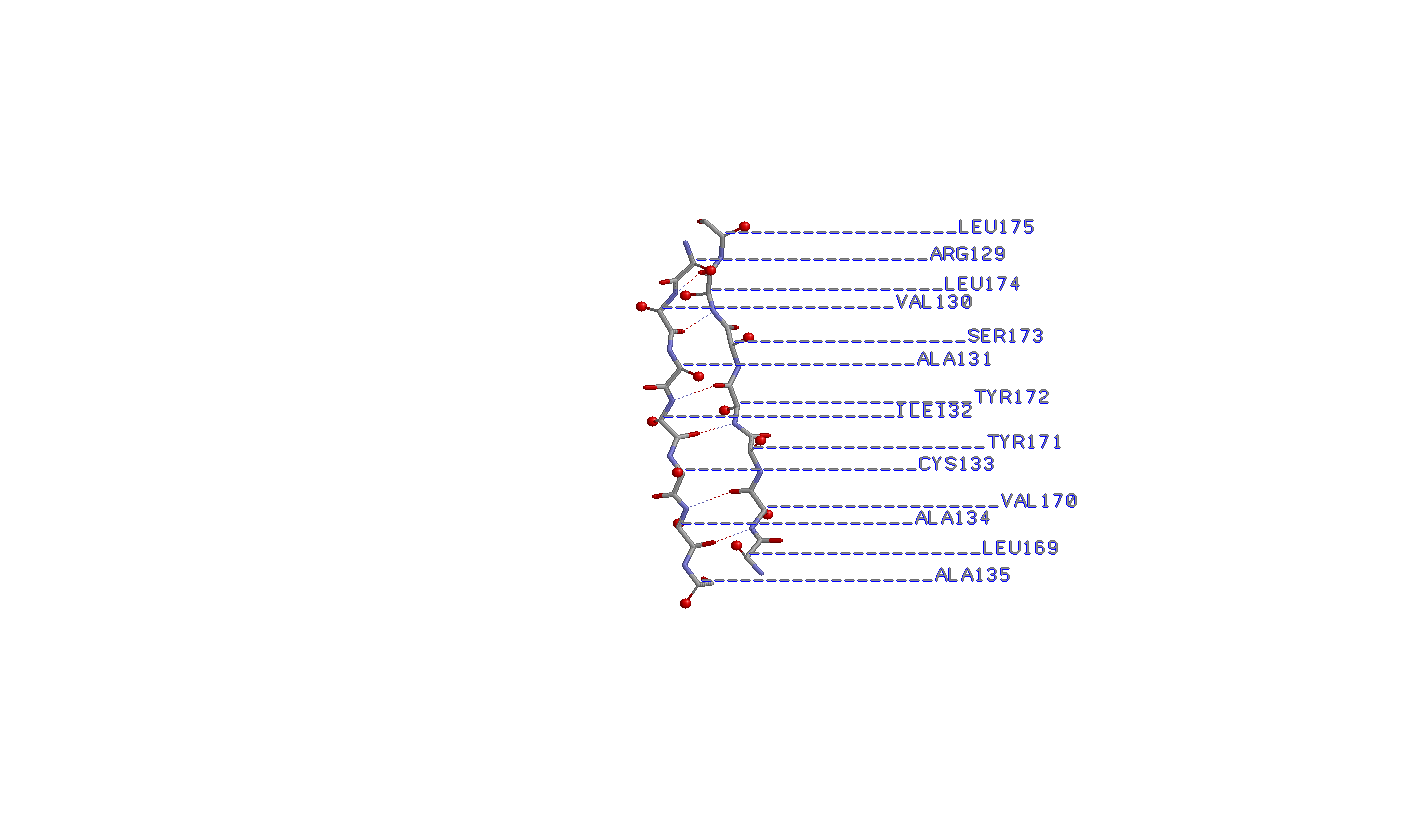
Аминокислоты в данных тяжах попарно образуют водородные связи (т.е. связи возникают между азотом и кислородом соседних аминокислот без смещения).
Бета-углеродные атомы располагаются поочередно над и под плоскостью листа, причем у соседних аминикислот расположение оных одинаково.
3. Исследование соседних параллельных β-тяжей
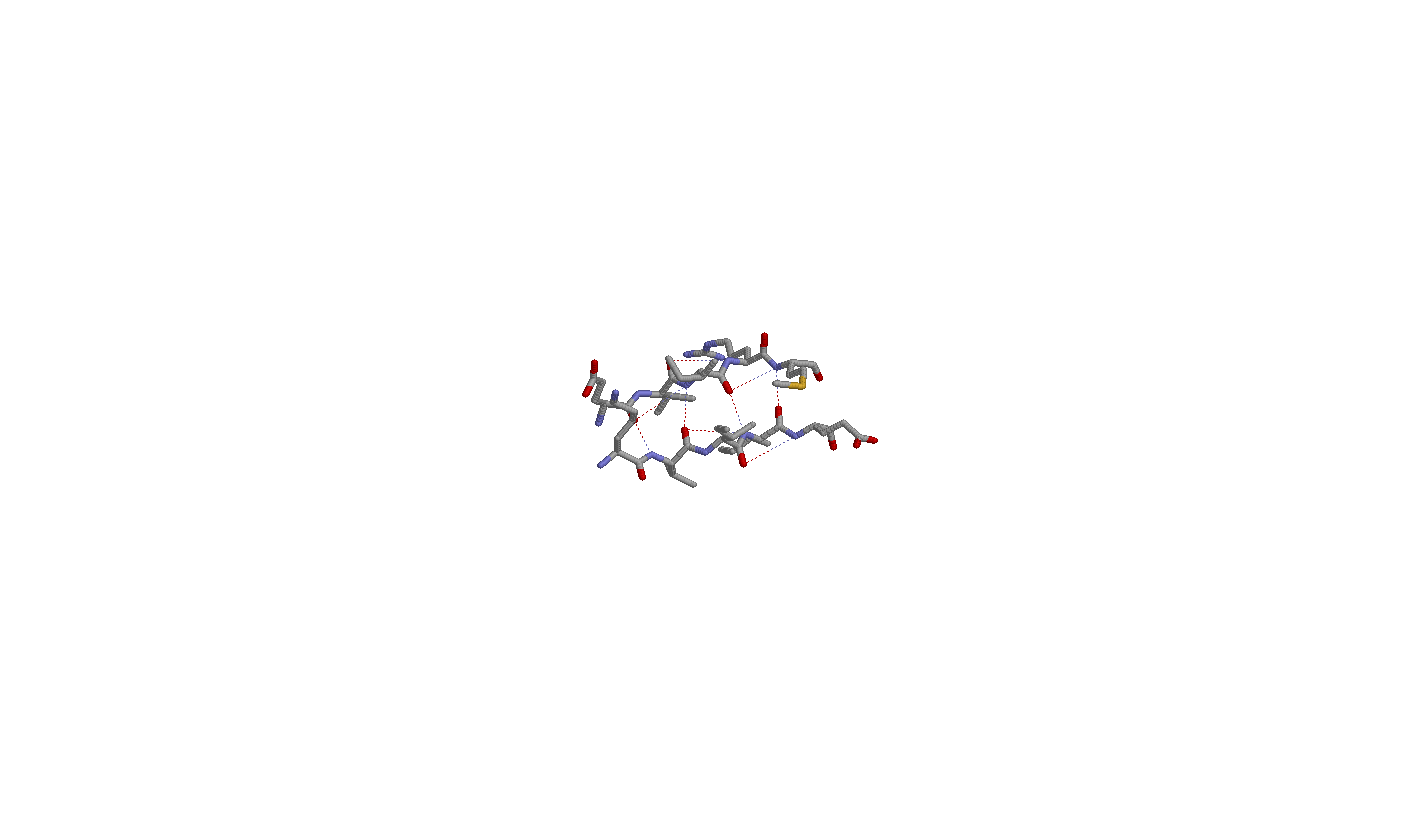


Водородные связи образуются между кислородом i-ого и азотом k+1-ого остатков соседних тяжей.
Расположение бета-углеродных атомов аналогично расположению в антипараллельных тяжах.
4. Исследование реверсивного поворота
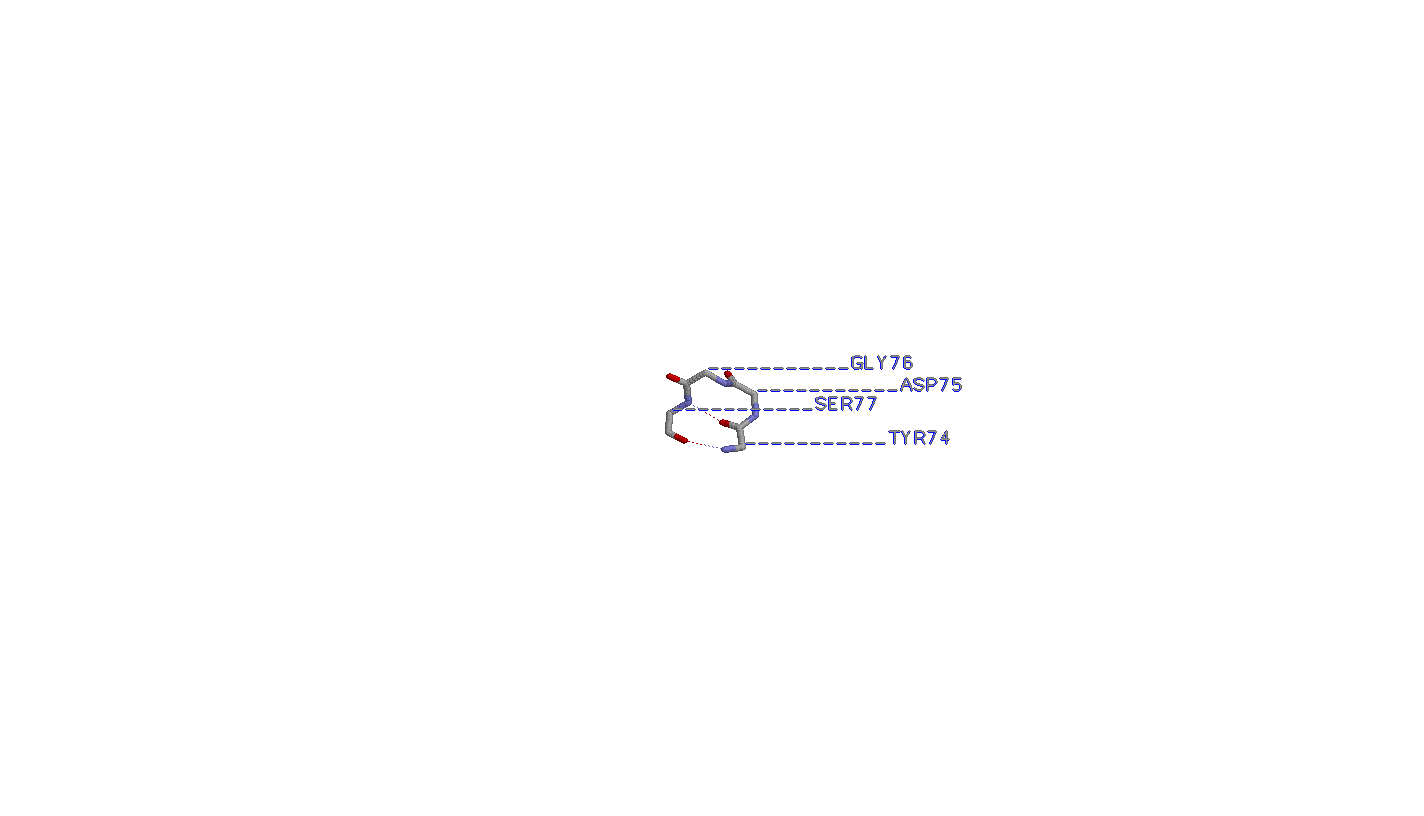
Бета-поворот образован двумя аминокислотами - глицином и аспарагином.
PDB файл белка
Скрипт к нему
Файл дополнитеьного белка
Скрипт к нему









