|
hhh
Hydrophobic
Hydrogen bonds
Disulfide bonds
Ligand
Resume
Save
|
|
hh
Ligand in general
Resume
Save
|
Татарча
English
Общая характеристика исследуемой структуры
|
Антитела (иммуноглобулины)- это группа гликопротеинов, составляющих один из главных белковых компонентов крови
(по весу примерно 20% суммарного белка плазмы) и обладающих способностью проникать в тканевые жидкости организма
и связываться там с чужеродными антигенами. Кроме связывания антигена,
антитела осуществляют одну или несколько эффекторных функций.
Структурные участки молекулы иммуноглобулина, ответственные за эффекторную активность
(за активацию комплимента или связывание, например, с фагоцитирующими клетками),
пространственно удалены от антигенсвязывающих центров и находятся главным образом в Fc – области.
Исследуемая структура представляет собой моноклональное мышиное антитело в комплексе с гаптеном.
Гипервариабельные участки антител
Каждый из вариабельных доменов имеет свой набор из трех гипервариабельных областей, уложенных в три гипервариабельные петли.
Гипервариабельные петли L- и Н- вариабельных доменов собраны в группу и образуют антиген-связывающий участок.
Вариабельная область молекулы антитела состоит из весьма консервативной жесткой структуры,
к одному из концов которой прикреплены гипервариабельные петли (L1, L2, L3, H1, H2, H3 - показаны на последней картинке, кнопка Ligand). [2][3][8]
|
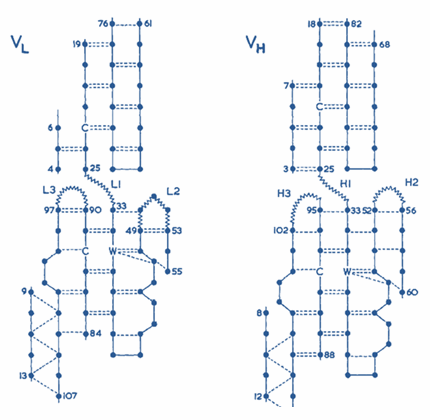
Рис. 1. Гипервариабельные участки молекулы антитела [2] |
Описание лиганда
Общие сведения о лиганде NPP представлены в таблице 1:
| PDB ID | 1BAF |
| IUPAC | N-(2-AMINO-ETHYL)-4,6-DINITRO-N'-(2,2,6,6-TETRAMETHYL-1-OXY-PIPERIDIN-4-YL)-BENZENE-1,3-DIAMINE |
| Химическая формула | 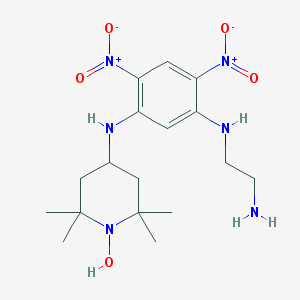 |
| Брутто-формула | C17H28N6O5 |
| Молярная масса | 396.448 g/mol |
| Ccылка на PubChem | 444511 |
Внутримолекулярные взаимодействия
Этот раздел посвящен исследованию межмолекулярных взаимодействий. В структуре 1BAF имеется две цепи. Между ними возможны следующие контакты:
1) Ковалентные (S-S мостики между цистеинами)
2) Ионные (между противоположно заряженными боковыми группами аминокислот)
3) Водородные
4) Гидрофобные взаимодействия
Ковалентные
Здесь разными цветами выделены атомы серы, относящиеся к разным цепям. Имеет место один дисульфидный мостик между цепями. Остальные 4 образованы цистеинами внутри цепи (по 2 в каждой). Тем не менее, ковалентная связь очень прочна, поэтому этот дисульфидный мостик несомненно играет роль в создании пространственной структуры молекулы.
Визуализация, доступная по нажатию кнопки возле апплета, получена при помощи сценария.
Водородные
Здесь разными цветами выделены разные цепи структуры, более темными оттенками помечены атомы, находящиеся на расстоянии не больше 3,5 ангстрем от противоположной цепи. Зеленым показаны водородные связи, между цепями их 13.
| Домен | Цепь | Количество водородных связей во вторичных структурах | Количество альфа-спиралей | Количество бета-тяжей |
|---|---|---|---|---|
| Домен 1 | L | 1 | 11 | 54 |
| Домен 2 | H | 1 | 10 | 24 |
| Домен 3 | H | 1 | 7 | 49 |
| Домен 4 | L | 2 | 8 | 58 |
Визуализация, доступная по нажатию кнопки возле апплета, получена при помощи следующего сценария.
В таблице приведена сравнительная характеристика элементов вторичной структуры по цепям и доменам. Вторичная структура белка в основном представлена бета-тяжами, альфа-спиралей всего 5. Данные получены с помощью данного скрипта.
Гидрофобные взаимодействия
Здесь разными цветами помечены гидрофобные радикалы аминокислот, имеющих в окружении (не дальше, чем 5 ангстрем) фенилаланин. По изображению на апплете видно 2 гидрофобных кластера, состоящих из боковых групп аминокислот разных цепей. Более четко границы кластеров можно определить, например, при помощи сервиса CluD. Однако поскольку большое количество гидрофобных радикалов аминокислот разных цепей обращены в сторону противоположной цепи и образуют скопление (на апплете подписаны расстояния между некоторыми атомами в кластерах гидрофобности), и без более детального разбирательства можно заключить, что гидрофобные взаимодействия играют важную роль в образовании данной пространственной структуры.
Визуализация, доступная по нажатию кнопки возле апплета, получена при помощи следующего сценария.
Ионные взаимодействия
Шариками разных цветов показаны заряженные атомы, вступающие в ионные взаимодействия с атомами противоположной цепи. Можно увидеть, что ионные взаимодействия между цепями имеют, однако их количество очень невелико. Поскольку эти связи слабее всех других исследованных типов взаимодействий, можно заключить, что их вклад в создание пространственной структуры незначительный.
| # | Атом с -NH3+-группой | Атом с -COO--группой | Расстояние между атомами N-O (A°) |
|---|---|---|---|
| Внутрицепочечные солевые мостики | |||
| 1 | [LYS]13:H | [GLU]115:H | 3.80 |
| 2 | [ARG]39:H | [GLU]47:H | 3.25 |
| 3 | [ARG]39:H | [ASP]90:H | 2.89 |
| 4 | [ARG]60:L | [GLU]80:L | 3.54 |
| 5 | [ARG]60:L | [ASP]81:L | 4.00(OD1), 3.70(OD2) |
| 6 | [ARG]67:H | [ASP]90:H | 3.86 |
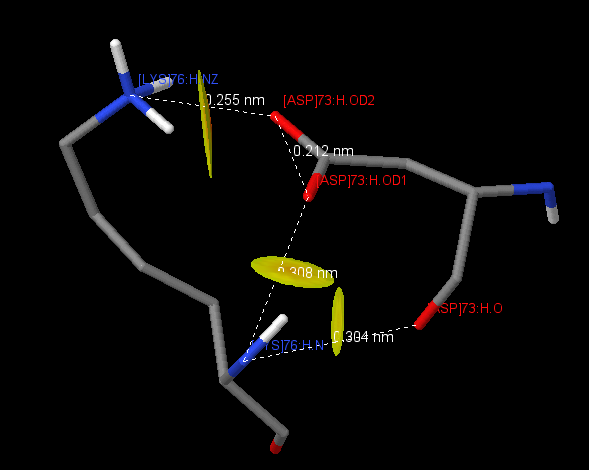
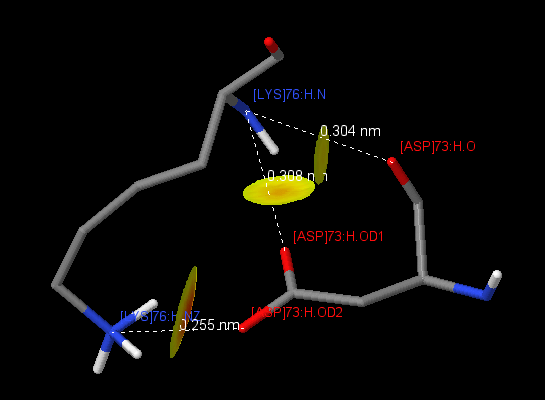
| 7 | [LYS]76:H | [ASP]73:H | 3.04(O), 3.08(OD1), 2.55(OD2) |
| 8 | [LYS]103:L | [GLU]105:L | 2.81 |
| 9 | [LYS]103:L | [ASP]165:L | 2.59(OD1), 2.74(OD2) |
| 10 | [LYS]142:L | [GLU]105:L | 2.80 |
| 11 | [LYS]199:L | [ASP]110:L | 2.74(OD1), 2.57(OD2) |
| 12 | [LYS]147:L | [GLU]154:L | 2.70(OE1)2.69(OE2) |
| 13 | [LYS]149:L | [GLU]195:L | 2.61(OE1), 2.70(OE2) |
| 14 | [LYS]183:L | [ASP]184:L | 2.65 |
| 15 | [ARG]188:L | [GLU]185:L | 3.94 |
| 16 | [ARG]215:H | [ASP]216:H | 3.94 |
| Межцепочечные солевые мостики | |||
| 1 | [LYS]210:H | [GLU]123:L | 2.75 |
| 2 | [ARG]215:H | [GLU]213:L | 3.11 |
Таблица 3 представляет пары аминокислотных остатков, образующих солевые мостики. Солевые мостики возникают за счет притяжения двух противоположно заряженных аминокислот (Arg+, His+, Lys+ и Asp-, Glu-), если расстояние между центрами зарядов не больше 4 А[1]. Данные контакты были обнаружены с помощью скрипта. В белке представлено 16 внутрицепочечных солевых мостика, 6 на цепи H и 10 на цепи L. 5 солевых мостика из 16 удовлетворяют параметрам водородной связи (длина связи 2.8-3.5 А). Интересен контакт между [LYS]76:H и [ASP]73:H (рис.1), между которыми образуется сразу три солевых мостика. Найденных межцепочечных солевых мостика всего два, и оба они подходят под определение водородной связи, из чего можно сделать вывод о том, что солевые мостики не вносят значительного вклада во взаимодействие между цепями.
Визуализация, доступная по нажатию кнопки возле апплета, получена при помощи следующего сценария.
 |
 |
|
Описание гидрофобного ядра вокруг остатка Phe118L (core4)В таблице представлены данные по остаткам, находящимся на расстоянии 1.0 - 7.0 А от Phe118 (гидрофобность, принадлежность тяжелой или легкой цепи антитела). Согласно скрипту, полученному с помощью CluD, центр гидрофобного ядра core4 примерно совпадает с MyResidue(Phe118). По данным составленной таблицы около 60,5% аминокислотных остатков в окружении исследуемого фенилаланина являются гидрофобными. Атомы, которые практически полностью покрывают поверхность остатка (при 100% Ван-дер-Ваальсовом радиусе), расположены на расстоянии более 4 А от него. Интересно, что увеличение минимального расстояния до 5, 6 А не приносит значительных результатов в "заслонении" лиганда; при увеличении минимального расстояния от атомов исследуемого остатка до хотя бы одного из атомов аминокислотного остатка окружения до 7 А, происходит значительное заслонение бензольного кольца фенилаланина (MyResidue). Характерное среднее расстояние между соседними не связанными ковалентно атомами в белке равно примерно 4.1 (4.09) А (было измерено вручную, на основе примеров расстояний между несвязанными ковалентно тяжелыми атомами в разных частях молекулы, далее было вычислено их среднее).
На последней картинке раздела Hydrophobic представлено изображение, с окраской MyResidue по силе взаимодействия с атомами других аминокислотных остатков. Видно, что наибольший вклад во взаимодействие с выбранным остатком вносят Pro119, Ile117, Val133.
Процедура поиска гидрофобного ядраПервоначально,с помощью команды restrict phe + wireframe 0.2 были выбраны фенилаланины (по рекомендациям практикума, тк эта аминокислота обладает ароматическим гидрофобным радикалом с относительно большой молекулярной массой. Далее select hydrophobic and not phe + wireframe 0.1 были показаны другие гидрофобные аминокислоты. Визуально определили, какой фенилаланин может быть центром гидрофобного ядра, с помощью команды define myresidue phe118:l определили его как MyResidue. Далее по скрипту, ссылка на который приведена выше, рассматривались аминокислотные остатки окружения, данные по ним были занесены в таблицу.Как уже упоминалось ранее, файл 1baf.pdb был загружен в CluD, откуда был получен скрипт для построения гидрофобных ядер в составе исследуемой белковой молекулы (точнее, с помощью скрипта визуализировались только некоторые атомы аминокислотных остатков, входящих в состав этих ядер). Аминокислотные остатки из CluD присутствовали в нашей выборке а.к. core4. По визуализации, представленной в апплете видно, что гидрофобные участки располагаются преимущественно на "стыке" двух цепей молекулы антитела. Это дает возможность предположить, что гидрофобные взаимодействия способствуют лучшему соединению цепей белковой молекулы (чуть более плотной расположение остатков друг относительно друга), что способствует образованию различных типов взаимодействий между атомами и более прочному поддержанию структуры. Известно, что гидрофобные взаимодействия энергетически выгодны в водных растворах (в отсутствии гидрофобных "хвостов", "заслоняющих" молекулы воды друг от друга, большее количество молекул воды может образовать водородные связи друг с другом, может образоваться большее разнообразие водородных связей, как следствие, возникает большее число доступных "вариантов ориентации"). Кроме того, гидрофобные взаимодействия могут способствовать "установлению" нескольких, наиболее выгодных конформаций белковой молекулы в водном растворе. [1] |
Лиганд - белковые взаимодействия
В ходе работы данного скрипта не было обнаружено какого-либо взаимодействия нитро-групп с амикокислотными остатками белка. Азоты N-(2-аминоэтильной) группы также не образуют ни солевых мостиков, ни водородных связей.
Пиперидиновая группа лиганда, вероятно, является липофильным участком, что подтверждается ее гидрофобным окружением: на расстоянии 4.0 А от группы находятся аминокислоты [TRP]90:L, [TRP]100:H and [TYR]31:L. Липофильные участки лиганда могут служить для проникновения в клетку через липидный бислой мембраны[5].
Скрипт для проверки наличия взаимодействий нитро-групп, N-(2-аминоэтиловой) и пиперидиновой групп.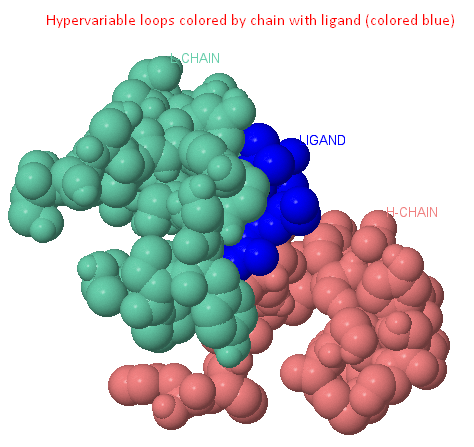 |
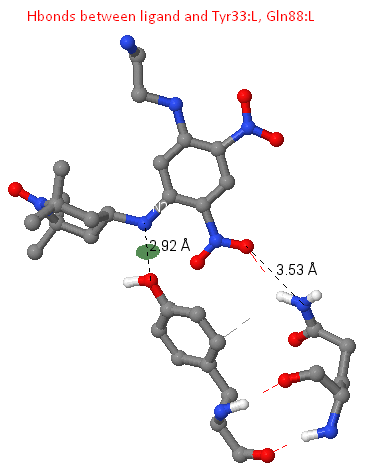 |
Водородные связи
Опишем найденные лиганд-белковые взаимодействия
Между атомом N2 лиганда и OH Tyr33:L найдена водородная связь длины 2.92 A. Есть данные по наличию так называемых мотивов связывания (константных участков) в составе гипервариабельных петель молекулы антитела. Одним из таких является Tyr 32 цепи L. В структуре исследуемого нами антитела этот тирозин, вероятно, "смещен" в 33 позицию участка L1 (предположение выдвинуто на основе того, в рассматриваемой нами структуре Tyr33:L участвует в связывании лиганда, таким образом, выполняя роли "утраченного" Tyr32:L, своего рода "компенсация"; находящийся в соседней к утраченному аминокислотноу остатку позиции Tyr31:L не участвует в связывании лиганда).
В составе рассматриваемой структуры есть водородная связь между атомом O2 лиганда и NE2 остатка Gln88:L, имеющая длину 3.53 A (обнаружена с помощью команды calculate hbonds).
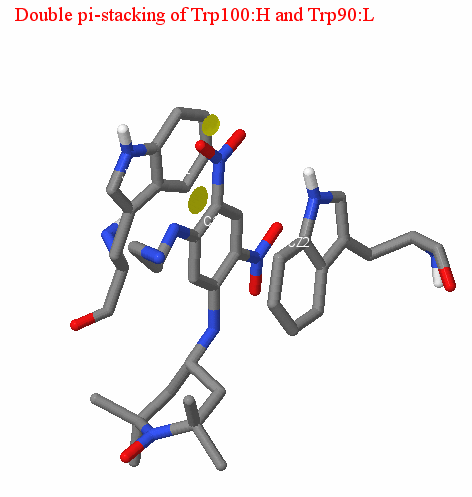
Двойной пи-стэкинг
Стоит также упомянуть о наличии двойного пи-стэкинга между бензольным кольцом лиганда и ароматической системой аминокислотных остатков антитела, который, вероятно, играет основную роль в связывании лиганда. пи-стэкингом называют нековалентное взаимодействие между органическими соединениями, содержащими ароматические компоненты, в результате которого происходит пересечение пи-орбиталей, обеспечивающее выигрыш в энтропии сформировавшегося комплекса в водной среде. Для пи-стэкинга характерно параллельное расположение двух арома-тических систем на расстоянии 3,5-4 А друг от друга. Также следует отметить, что участвующими в пи-стэкинге ароматическими остатками в большинстве случаев являются триптофан и тирозин. В случае исследуемой нами структуры двойной пи-стэкинг обеспечивается взаимодействием лиганда с Trp90:L (среднее расстояние 3.94 A) и Trp100:H (среднее расстояние 3.52 A); (см. картинки). Расстояние между ароматическими системами в рассматриваемом комплексе антиген-антитело соответствует оптимальному (по данным статьи [4]); таким образом, мы можем сделать вывод, что описанное взаимодействие может существовать.
 |
 |
Личный вклад
Данный проект выполнен отличнейшей командой представительниц прекрасного пола: Беляевой Юлией, Нефедовой Анастасией, Розиной Анной. БЮ изучала гидрофобные ядра, лиганд-белковые контакты (пи-стекинг, водородные связи), а также взяла на себя ответсвенность по загрузке апплетов, перевод на татарский язык, общее описание белка. НА работала над лиганд-белковыми взаимодействиями, солевыми мостиками, внутрицепочечными водородными связями, совместно с РА выполнила перевод на английский язык. РА исследовала все виды межмолекулярных контактов, дисульфидные мостики, совместно с НА выполнила перевод на английский язык.
Список литературы
[1] Tanford C. Contribution of hydrophobic interactions to the stability of the globular conformation of proteins //Journal of the American Chemical Society. – 1962. – Т. 84. – №. 22. – С. 4240-4247
[2] Chothia C., Lesk A. M. Canonical structures for the hypervariable regions of immunoglobu-lins //Journal of molecular biology. – 1987. – Т. 196. – №. 4. – С. 901-917
[3] North B., Lehmann A., Dunbrack R. L. A new clustering of antibody CDR loop conformations //Journal of molecular biology. – 2011. – Т. 406. – №. 2. – С. 228-256
[4] Arzhanik V. et al. Interaction of antibodies with aromatic ligands: the role of ?-stacking //Journal of bioinformatics and computational biology. – 2010. – Т. 8. – №. 03. – С. 471-483
[5] https://www.rcsb.org/structure/5LBY
[6] K.M. Zelenin: Physiologically active complexes of hydrazones, 1996
[7] https://www.ncbi.nlm.nih.gov/Structure/MMDB/docs/mmdb_help.html#WhatIs
[8] Martin A. C. R., Thornton J. M. Structural families in loops of homologous proteins: auto-matic classification, modelling and application to antibodies //Journal of molecular biology. – 1996. – Т. 263. – №. 5. – С. 800-815