|
hhh
Суны-курку узаралар
Водород узаралар
Ике-күкерт узаралар
Кисәкчә
Дәвам итәргә
Саклау рәсемне
|
|
hh
Кисәкчә турында гомумән алганда
Дәвам итәргә
Саклау рәсемне
|
Русча
Инглизчә
Структурабызның гомуми характеристика
|
Атитела (имунноглобулиннар) - бу гликопротеиннар группасы,
кан берсе компонентлардан бик мөҺим компоненты (20% плазманың аксым);
алар организм сыеклыкка керергә мөмкин.
Антитела эффектор функциясен ясарга ала. Иммуноглобулин
молекуланың структурасы өлешендәләр
антиген белән хезмәттәшлек-итәрү
үзәкләрдән еракл урнашкан.
Күбесенчә алар Fc-өлкәсендә урнашкан.
Структурабыз бу тычканның моноклональ антитело гаптен белән.
Антителаларның гипервариабль участоклары
Вариабль доменнардан Һәр домен өч гипервариабль өлкәләрдән үз туплау бар. Алар өч элмәкләрдә төргән.
L- Һәм H- гипервариабль элмәкләр группага Җыештырган. Алар антиген-тоту-өчен участок ясыйлар.
Антитело молекулның вариабль өлкәсендә бик таләпчән структурасын бар. Монда L1-, L2-, L3-, H1-, H2-, H3- элмәкләр бар.
Алар соңгы рәсемдә сурәтләнгәннәр (кнопка Кисәкчә). [2][3][8]
|
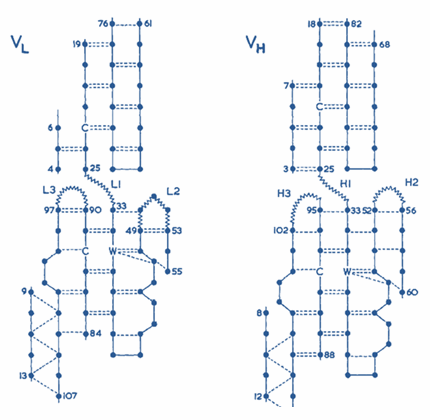
Рәс. 1. Антителаларның гипервариабль участоклары [2] |
Кисәкчәнең тасвирламасы
Кисәкчә (NPP) турында төп мәгълүмат беренче таблицада:
| PDB ID | NPP |
| IUPAC | N-(2-AMINO-ETHYL)-4,6-DINITRO-N'-(2,2,6,6-TETRAMETHYL-1-OXY-PIPERIDIN-4-YL)-BENZENE-1,3-DIAMINE |
| Химик формуласы | 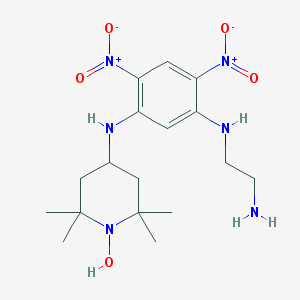 |
| Брутто-формуласы | C17H28N6O5 |
| Моляр авырлыгы | 396.448 g/mol |
| PubChem-сайтка ссылка | 444511 |
Скриптның тексты нитро-төркеменеҢ, N-(2-аминоэтилның) Һәм пипердинлы төркеменеҢ узараны тикшерү өчен моннан бир әле.
Молекула эчендә узаралар
Бу бүлек тикшеренүгә (молекулаларның узаралары турында) багышлана. 1BAF структурда ике чылбырыннар бар. Алар арасында бу контактлар бар:
1) Ковалент узаралар(S-S күперчекләр ике цистеиннар арасында)
2) Ион узаралар (аминокислоталарның каршы кару яндагы төркемнәре арасында)
3) Водород узаралар
4) Суны-курку узаралар
Ковалент узаралар
Монда төрле төсләр белән сераның атомнары бүлеп бирелгән (бу атомнар төрле чылбырыннарда урнашкан). Ике чылбырыннар арасында дисульфид күперчек бар. Калганнары дүрт күперчекләр чылбырын эчендә цистеиннар белән ясалган. Шуңа да карамастан, ковалент узара бик нык икән, шуҢа күре бу дисульфид күперчек объем структурасын төзү өчен мөҺим.
Апплетның скрипты моннан кар әле.
Водород узаралар
Монда төрле төстә структурның чылбырыннары бүлеп бирелгән. Атомнар каршы чылбырыннан 3,5 Ангстрем күбрәк түгел ераклыкта урнашкан "карарак" төстәге сүрәтләнгән. Водород узаралар яшел төстәге (структурабызда, чылбырыннар арасында аларны 13 бар).
 |
 |
| Домен | Чылбырын | Икенчеле структурада водород узараларының саны | Альфа-спиралләр саны | Бета-катламнар саны |
|---|---|---|---|---|
| Домен 1 | L | 1 | 11 | 54 |
| Домен 2 | H | 1 | 10 | 24 |
| Домен 3 | H | 1 | 7 | 49 |
| Домен 4 | L | 2 | 8 | 58 |
Таблицасында - икенчел структурасы элементларны ң характеристикасы чылбырыннар Һәм доменнар буенча . Аксымны ң икенчел структурасы , нигездә, бета-катламнар белән тәкъдим ителгән; биш альфа-спираллар бар. Мәгълумат бу скрипт ярдәмендә алган .
Суны - курку узаралар
Монда аминокислоталарның суны-курку радикалларын төрле төстә сурәтләнгәнм (алар янында фенилаланин урнашкан; кимендә 5 Ангстрем). Аплетта без ике суны-курку кластерлар күрәбез (алар аминокислоталарның (ике төрле чылбырыннардан) радикалларыннан ясалган). Без чикләре артык төгәл билгеләргә булдырабыз (СluD белән). Суны-курку узаралар (ике чылбырыннар арасында) структурасын оештыру зур роль уйныйлар.
Апплетның скрипты моннан кар әле.
Ион узаралар
Шарикалар, төрле төстә заряд белән атомнар с үрәтләнгән. Алар ике чылбырыннар арасында ион узаралар ясадылар. әмма аларны (ион узараларны) бик аз. Алар артык йомшак, караганда башка бәйләнеш (структурасын ясауда кечкенә роль уйныйлар)
| # | Атом -NH3+-группа белән | Атом -COO--группа белән | Атомнар арасы ераклыгыN-O (A°) |
|---|---|---|---|
| Тозлы күперләр чылбырында | |||
| 1 | [LYS]13:H | [GLU]115:H | 3.80 |
| 2 | [ARG]39:H | [GLU]47:H | 3.25 |
| 3 | [ARG]39:H | [ASP]90:H | 2.89 |
| 4 | [ARG]60:L | [GLU]80:L | 3.54 |
| 5 | [ARG]60:L | [ASP]81:L | 4.00(OD1), 3.70(OD2) |
| 6 | [ARG]67:H | [ASP]90:H | 3.86 |
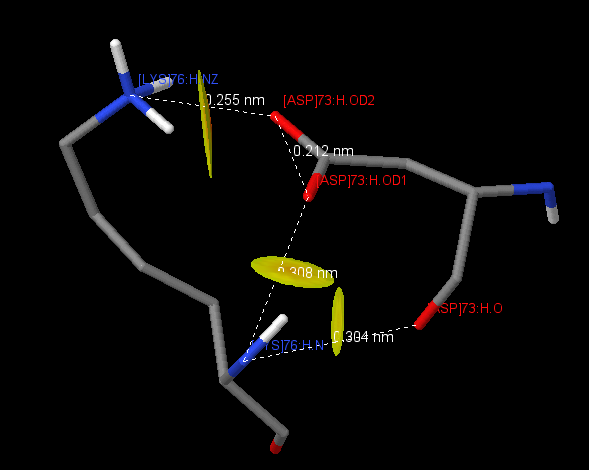
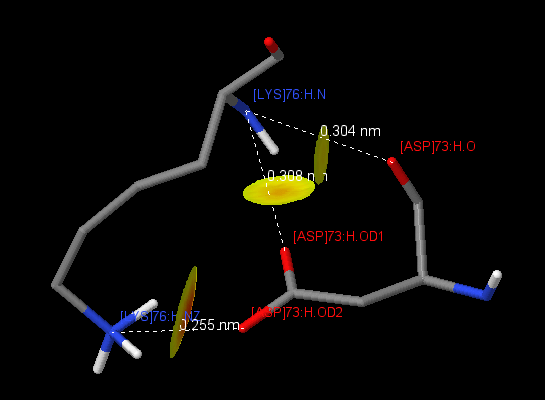
| 7 | [LYS]76:H | [ASP]73:H | 3.04(O), 3.08(OD1), 2.55(OD2) |
| 8 | [LYS]103:L | [GLU]105:L | 2.81 |
| 9 | [LYS]103:L | [ASP]165:L | 2.59(OD1), 2.74(OD2) |
| 10 | [LYS]142:L | [GLU]105:L | 2.80 |
| 11 | [LYS]199:L | [ASP]110:L | 2.74(OD1), 2.57(OD2) |
| 12 | [LYS]147:L | [GLU]154:L | 2.70(OE1)2.69(OE2) |
| 13 | [LYS]149:L | [GLU]195:L | 2.61(OE1), 2.70(OE2) |
| 14 | [LYS]183:L | [ASP]184:L | 2.65 |
| 15 | [ARG]188:L | [GLU]185:L | 3.94 |
| 16 | [ARG]215:H | [ASP]216:H | 3.94 |
| Тозлы күперләр чылбырыннар арасында | |||
| 1 | [LYS]210:H | [GLU]123:L | 2.75 |
| 2 | [ARG]215:H | [GLU]213:L | 3.11 |
Апплетның скрипты моннан кар әле.
Таблица 3 представляет пары аминокислотных остатков, образующих солевые мостики. Солевые мостики возникают за счет притяжения двух противоположно заряженных аминокислот (Arg+, His+, Lys+ и Asp-, Glu-), если расстояние между центрами зарядов не больше 4 А[1]. Данные контакты были обнаружены с помощью скрипта. В белке представлено 16 внутрицепочечных солевых мостика, 6 на цепи H и 10 на цепи L. 5 солевых мостика из 16 удовлетворяют параметрам водородной связи (длина связи 2.8-3.5 А). Интересен контакт между [LYS]76:H и [ASP]73:H (рис.1), между которыми образуется сразу три солевых мостика. Найденных межцепочечных солевых мостика всего два, и оба они подходят под определение водородной связи, из чего можно сделать вывод о том, что солевые мостики не вносят значительного вклада во взаимодействие между цепями.
|
Описание гидрофобного ядра вокруг остатка Phe118L (core4)В таблице представлены данные по остаткам, находящимся на расстоянии 1.0 - 7.0 А от Phe118 (гидрофобность, принадлежность тяжелой или легкой цепи антитела). Согласно скрипту, полученному с помощью CluD, центр гидрофобного ядра core4 примерно совпадает с MyResidue(Phe118). По данным составленной таблицы около 60,5% аминокислотных остатков в окружении исследуемого фенилаланина являются гидрофобными. Атомы, которые практически полностью покрывают поверхность остатка (при 100% Ван-дер-Ваальсовом радиусе), расположены на расстоянии >4 А от него. Интересно, что увеличение минимального расстояния до 5, 6 А не приносит значительных результатов в "заслонении" лиганда; при увеличении минимального расстояния от атомов исследуемого остатка до хотя бы одного из атомов аминокислотного остатка окружения до 7 А, происходит значительное заслонение бензольного кольца фенилаланина (MyResidue). Характерное среднее расстояние между соседними не связанными ковалентно атомами в белке равно примерно 4.1 (4.09) А.
На последней картинке раздела Hydrophobic представлено изображение, с окраской MyResidue по интенсивности контакта с атомами других аминокислотных остатков. Видно, что наибольший вклад во взаимодействие с выбранным остатком вносят Pro119, Ile117, Val133.
Процедура поиска гидрофобного ядраПервоначально,с помощью команды restrict phe + wireframe 0.2 были выбраны фенилаланины (по рекомендациям практикума, тк эта аминокислота обладает ароматическим гидрофобным радикалом с относительно большой молекулярной массой. Далее select hydrophobic and not phe + wireframe 0.1 были показаны другие гидрофобные аминокислоты. Визуально определили, какой фенилаланин может быть центром гидрофобного ядра, с помощью команды define myresidue phe118:l определили его как MyResidue. Далее по скрипту, ссылка на который приведена выше, рассматривались аминокислотные остатки окружения, данные по ним были занесены в таблицу.Как уже упоминалось ранее, файл 1baf.pdb был загружен в CluD, откуда был получен скрипт для построения гидрофобных ядер в составе исследуемой белковой молекулы (точнее, с помощью скрипта визуализировались только некоторые атомы аминокислотных остатков, входящих в состав этих ядер). Аминокислотные остатки из CluD присутствовали в нашей выборке а.к. core4. По визуализации, представленной в апплете видно, что гидрофобные участки располагаются преимущественно на "стыке" двух цепей молекулы антитела. Это дает возможность предположить, что гидрофобные взаимодействия способствуют лучшему соединению цепей белковой молекулы (чуть более плотной расположение остатков друг относительно друга), что способствует образованию различных типов взаимодействий между атомами и более прочному поддержанию структуры. Известно, что гидрофобные взаимодействия энергетически выгодны в водных растворах (в отсутствии гидрофобных "хвостов", "заслоняющих" молекулы воды друг от друга, большее количество молекул воды может образовать водородные связи друг с другом, может образоваться большее разнообразие водородных связей, как следствие, возникает большее число доступных "вариантов ориентации"). Кроме того, гидрофобные взаимодействия могут способствовать "установлению" нескольких, наиболее выгодных конформаций белковой молекулы в водном растворе. [1] |
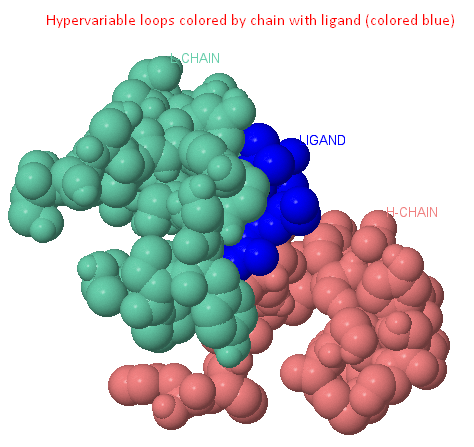
Лиганд - белковые взаимодействия
Шул скрипт эш вакытта без нитро-төркемнәр аксымның аминокислоталар белән узараларын тапмадык. N-(2-аминоэтил) төркемнең азотлары тозлы күперчекләрне Һәм водород узараларын ясамыйлар.
Кисәкчәнең пипередин төркеме, бәлки, липофил бер өлеше кебек. Бу мәгълүмат аның суны-курку әйләнә белән раслана (Trp90:L, Trp100:H Һәм Tyr31:L төркемнән 4 Ангстрем ераклыкта урнашкан). Кисәкчәнең липофил өлкәсе клеткага үтеп керү өчен хезмәт итәргә ала. [5].
 |
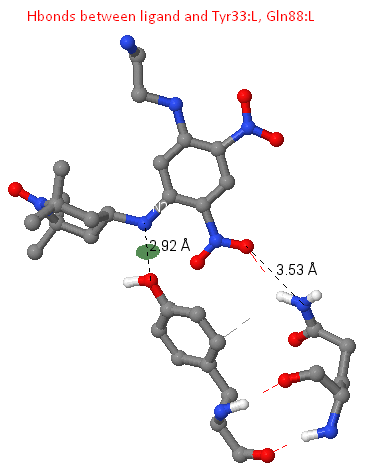 |
Водородные связи
Опишем найденные лиганд-белковые взаимодействия
Между атомом N2 лиганда и OH Tyr33:L найдена водородная связь длины 2.92 A. Есть данные по наличию так называемых мотивов связывания (константных участков) в составе гипервариабельных петель молекулы антитела. Одним из таких является Tyr 32 цепи L. В структуре исследуемого нами антитела этот тирозин, вероятно, "смещен" в 33 позицию участка L1.
В составе рассматриваемой структуры есть водородная связь между атомом O2 лиганда и NE2 остатка Gln88:L, имеющая длину 3.53 A (обнаружена с помощью команды calculate hbonds).
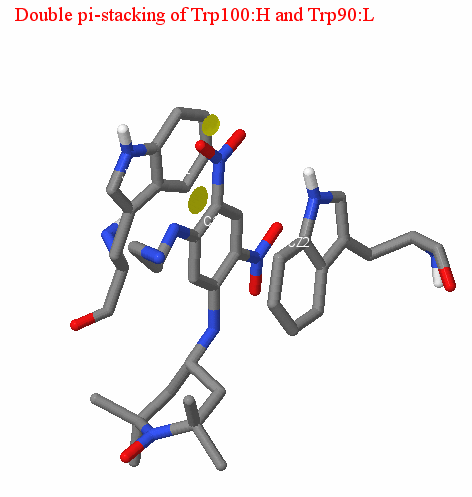
Двойной пи-стэкинг
Стоит также упомянуть о наличии двойного пи-стэкинга между бензольным кольцом лиганда и ароматической системой аминокислотных остатков антитела. пи-стэкингом называют нековалентное взаимодействие между органическими соединениями, содержащими ароматические компоненты, в результате которого происходит пересечение пи-орбиталей, обеспечивающее выигрыш в энтропии сформировавшегося комплекса в водной среде. Для пи-стэкинга характерно параллельное расположение двух арома-тических систем на расстоянии 3,5-4 А друг от друга. Также следует отметить, что участвующими в пи-стэкинге ароматическими остатками в большинстве случаев являются триптофан и тирозин. В случае исследуемой нами структуры двойной пи-стэкинг обеспечивается взаимодействием лиганда с Trp90:L (среднее расстояние 3.94 A) и Trp100:H (среднее расстояние 3.52 A); (см. картинки). Расстояние между ароматическими системами в рассматриваемом комплексе антиген-антитело соответствует оптимальному (по данным статьи [4]); таким образом, мы можем сделать вывод, что описанное взаимодействие действует.
 |
 |
Личный вклад
Список литературы
[1] Tanford C. Contribution of hydrophobic interactions to the stability of the globular conformation of proteins //Journal of the American Chemical Society. – 1962. – Т. 84. – №. 22. – С. 4240-4247
[2] Chothia C., Lesk A. M. Canonical structures for the hypervariable regions of immunoglobu-lins //Journal of molecular biology. – 1987. – Т. 196. – №. 4. – С. 901-917
[3] North B., Lehmann A., Dunbrack R. L. A new clustering of antibody CDR loop conformations //Journal of molecular biology. – 2011. – Т. 406. – №. 2. – С. 228-256
[4] Arzhanik V. et al. Interaction of antibodies with aromatic ligands: the role of ?-stacking //Journal of bioinformatics and computational biology. – 2010. – Т. 8. – №. 03. – С. 471-483
[5] https://www.rcsb.org/structure/5LBY
[6] K.M. Zelenin: Physiologically active complexes of hydrazones, 1996
[7] https://www.ncbi.nlm.nih.gov/Structure/MMDB/docs/mmdb_help.html#WhatIs