Описание белка
Хитиназы принадлежат к классу гликоцил гидролаз, которые разлагают хитин, насыщенный природный полисахарид, путём отщепления β-(1,4) связей
от его N-ацетилглюкозамин цепи (Gooday, 1990). Наш белок(PDB ID: 4WKH) является каталитическим доменом одной из таких хитиназ, хитотриозидазы-1(CHIT1),
которая принадлежит к высококонсервативному гликоцил гидролазному семейству 18 (GH18). Это одна из двух активных хитиназ, которые были обнаружены в человеке.
Так же было обнаружено её участие во врожденном иммунном ответе, кроме того, она является биомаркером болезни Гоше (Hollak et al.,1994)
(этот лизосомный фермент очень полезен в мониторинге развития болезни Гоше в ответ на лечение и может давать понимание тяжести заболевания).
Болезнь Гоше вызывается генетическим расстройством, в результате которого глюкоцереброзид накапливается в клетках и некоторых органах. Это расстройство
характеризуется синяками, усталостью, анемией, низким количеством тромбоцитов в крови и увеличением печени и селезенки.
Болезнь вызывается наследственным дефицитом фермента глюкоцереброзидазы (также известной как глюкозилцерамидаза), которая действует на глюкоцереброзид.
Ниже представлен механизм гидролиза CHIT1, предложенный Fadel et al., 2015:
 Вы можете посмотреть на каталитический центр с помощью апплета Jmol(кнопка "Interactions with Ligand") (некоторые конфигурации накладываются друг на друга,
приводя к тому, что некоторые аминокислоты выглядят "двуглавыми"). Лиганд является мономером хитина.
Вы можете посмотреть на каталитический центр с помощью апплета Jmol(кнопка "Interactions with Ligand") (некоторые конфигурации накладываются друг на друга,
приводя к тому, что некоторые аминокислоты выглядят "двуглавыми"). Лиганд является мономером хитина.
Процесс выделения контактов
Для идентификации водородных связей в первую очередь была проанализирована вторичная структура. В дальнейшем мы выделяли сайты, где водородные связи не были
частью каких-либо α-спиралей или β-слоев. Для того, чтобы определить солевые мостики и гидрофобные контакты, мы смотрели на заряженные аминокислоты
и гидрофобные аминокислоты соответственно. Дисульфидные мостики были выявлены посредством выделения всех цистеинов. Взаимодействия с лигандом были показаны
посредством постепенного удаления выбранной области вокруг лиганда.
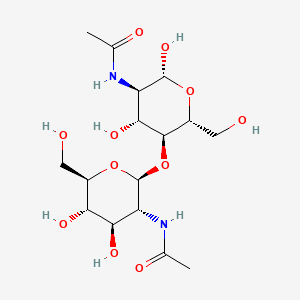
Лиганд:
Взаимодействия белка с лигандом:

Расчёты

Для идентификации водородных связей в первую очередь была проанализирована вторичная структура. В дальнейшем мы выделяли сайты, где водородные связи не были
частью каких-либо α-спиралей или β-слоев. Для того, чтобы определить солевые мостики и гидрофобные контакты, мы смотрели на заряженные аминокислоты
и гидрофобные аминокислоты соответственно. Дисульфидные мостики были выявлены посредством выделения всех цистеинов. Взаимодействия с лигандом были показаны
посредством постепенного удаления выбранной области вокруг лиганда.
Лиганд:
Взаимодействия белка с лигандом:


Расчёты
| Названия атомов | Расстояния (Å) | Угол (°) |
| Водородные связи | ||
| N(296:A LYS)-O(292:A GLY) | 3.05 | 128.0 |
| N(228:A LEU)-O(320:A GLN) | 2.98 | 143.9 |
| N(10:A SER)-O(6:A GLY) | 3.16 | 130.5 |
| Солевые мостики | ||
| Названия атомов | Расстояния (Å) | |
| OD2(205:A ASP)-NH2(177:A ARG) | 3.79 | |
| OD1(205:A ASP)-NH1(177:A ARG) | 3.39 | |
| OD1(205:A ASP)-NH2(177:A ARG) | 2.74 | |
| OD2(205:A ASP)-NH1(177:A ARG) | 2.90 | |
| OE1(169:A GLU)-NH2(128:A ARG) | 2.87 | |
| OE2(169:A GLU)-NE(128:A ARG) | 2.85 | |
| OD2(133:A ASP)-NZ(84:A LYS) | 2.85 | |
| OD1(133:A ASP)-NZ(84:A LYS) | 3.41 | |
| Дисульфидные мостики | ||
| SG(51:A CYS)-SG(26:A CYS) | 2.85 | |
| SG(370:A CYS)-SG(307:A CYS) | 3.41 | |
Информация о лиганде
| Название по номенклатуре IUPAC | N-[(2R,3R,4R,5S,6R)-5-[(2S,3R,4R,5S,6R)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2,4-dihydroxy-6-(hydroxymethyl)oxan-3-yl]acetamide | |
| Молекулярная формула | C16H28N2O11 | |
| Молярная масса | 424.403 гр/моль | |
| Страница на PubChem | ||
Гидрофобное ядро
Был проведен анализ гидрофобного ядра белка. Сервис анализа гидрофобных кластеров CluD показал наличие 6 гидрофобных ядер, однако все они, за исключением первого,
включали в себя менее 10 атомов, вследствие чего не рассматривались. Результаты работы можно лицезреть в окне апплета и на изображениях ниже. Для перемещения по
изображениям в апплете используются кнопки Ядро и Продолжить (Ядро).
Плотность расположения атомов в ядре

На рисунке выше можно видеть, что чем больше расстояние от остатка, тем больше атомов встречается на таком расстоянии. Однако данное увеличение неоднородно: на расстоянии
3-4 и 4-5 ангстрем находится значительно больше атомов, чем должно было бы находиться при подобном ходе кривой. Из этого можно сделать вывод, что распределение гидрофобных
атомов в ядре не случайно. На расстоянии 3-5 ангстрем их находится больше, чем того стоило бы ожидать, поэтому можно говорить о более уплотненной укладке на данных радиусах.
Минимальное расстояние
Стоит отметить, что даже на максимальном, в рамках данного практикума, расстоянии в 7 ангстрем сквозь ван-дер-ваальсовы радиусы соседних атомов все еще просвечивала
поверхность остатка. В связи с зыбкостью и неконкретностью критерия "практически не видно атомов", решено было остановиться на расстоянии в 6 ангстрем. Атомы на расстоянии
в 6 ангстрем от остатка покрывают его поверхность так, что ее практически не видно.
Характерное расстояние
Из приведенной выше диаграммы видно, при увеличении расстояния от 3 ангстрем до 5 происходит многократное увеличение количества атомов. Наибольшая поверхность остатка
так же покрывается на расстоянии 3-5 ангстрем, что следует из изображений апплета. При этом ковалентно-связанные атомы отпадают еще на стадии 2-3 ангстрем, что так же
следует из апплета. Поэтому можно с увереностью сказать, что характерное расстояние между несвязанными ковалентно атомами в белке точно меньше 5 ангстрем, и составляет
порядка 3-4 оных.
Молекула воды
Рассчет возможности нахождения молекулы воды между соседними атомами белка, при наличии изложенных выше данных, становится весьма тривиальным. Очевидно, что для того, чтобы
молекула воды попала между двумя атомами, необходимо, чтобы сумма радиусов двух этих атомов, сложенная с диаметром молекулы воды, была бы меньше характерного расстояния.
Однако даже при самом "оптимистичном" рассчете вышеуказанная сумма равняется 5.6 ангстремам, что превышает все мыслимые и немыслимые границы.
Авторы
Станислав Тихонов и Семён Коннов нашли и проанализировали Белковые контакты, создали
Jmol скрипты, отвечающие за их визуализацию. Станислав Тихонов создал визуальную модель лиганда, его взаимодействий с белком,
проанализировал биологическую роль белка, а так же создал описание на английском и татарском.
Семён Коннов перевел описание белка на русский, перевел описание гидрофобного ядра
на английский при участии Станислава Тихонова.
Руслан Гумеров проанализировал парметры гидрофобного ядра и написал его описание на русском, создал CSS/HTML код веб-страницы.
Литература
[1]Gooday, G. (1990). Adv. Microb. Ecol. 11, 387-430.
[2]Hollak, C. E., van Weely, S., van Oers, M. H. & Aerts, J. M. (1994). J. Clin. Invest. 93, 1288-1292.
[3]Fadel, F., Zhao, Y., Cachau, R., Cousido-Siah, A., Ruiz, F.X., Harlos, K., Howard, E., Mitschler, A., Podjarny, A. (2015). Acta Cryst. 71, 1455-1470.

Минимальное расстояние
Стоит отметить, что даже на максимальном, в рамках данного практикума, расстоянии в 7 ангстрем сквозь ван-дер-ваальсовы радиусы соседних атомов все еще просвечивала
поверхность остатка. В связи с зыбкостью и неконкретностью критерия "практически не видно атомов", решено было остановиться на расстоянии в 6 ангстрем. Атомы на расстоянии
в 6 ангстрем от остатка покрывают его поверхность так, что ее практически не видно.
Характерное расстояние
Из приведенной выше диаграммы видно, при увеличении расстояния от 3 ангстрем до 5 происходит многократное увеличение количества атомов. Наибольшая поверхность остатка
так же покрывается на расстоянии 3-5 ангстрем, что следует из изображений апплета. При этом ковалентно-связанные атомы отпадают еще на стадии 2-3 ангстрем, что так же
следует из апплета. Поэтому можно с увереностью сказать, что характерное расстояние между несвязанными ковалентно атомами в белке точно меньше 5 ангстрем, и составляет
порядка 3-4 оных.
Молекула воды
Рассчет возможности нахождения молекулы воды между соседними атомами белка, при наличии изложенных выше данных, становится весьма тривиальным. Очевидно, что для того, чтобы
молекула воды попала между двумя атомами, необходимо, чтобы сумма радиусов двух этих атомов, сложенная с диаметром молекулы воды, была бы меньше характерного расстояния.
Однако даже при самом "оптимистичном" рассчете вышеуказанная сумма равняется 5.6 ангстремам, что превышает все мыслимые и немыслимые границы.
Авторы
Станислав Тихонов и Семён Коннов нашли и проанализировали Белковые контакты, создали
Jmol скрипты, отвечающие за их визуализацию. Станислав Тихонов создал визуальную модель лиганда, его взаимодействий с белком,
проанализировал биологическую роль белка, а так же создал описание на английском и татарском.
Семён Коннов перевел описание белка на русский, перевел описание гидрофобного ядра
на английский при участии Станислава Тихонова.
Руслан Гумеров проанализировал парметры гидрофобного ядра и написал его описание на русском, создал CSS/HTML код веб-страницы.
Литература
[1]Gooday, G. (1990). Adv. Microb. Ecol. 11, 387-430.
[2]Hollak, C. E., van Weely, S., van Oers, M. H. & Aerts, J. M. (1994). J. Clin. Invest. 93, 1288-1292.
[3]Fadel, F., Zhao, Y., Cachau, R., Cousido-Siah, A., Ruiz, F.X., Harlos, K., Howard, E., Mitschler, A., Podjarny, A. (2015). Acta Cryst. 71, 1455-1470.
Семён Коннов перевел описание белка на русский, перевел описание гидрофобного ядра на английский при участии Станислава Тихонова.
Руслан Гумеров проанализировал парметры гидрофобного ядра и написал его описание на русском, создал CSS/HTML код веб-страницы.
[3]Fadel, F., Zhao, Y., Cachau, R., Cousido-Siah, A., Ruiz, F.X., Harlos, K., Howard, E., Mitschler, A., Podjarny, A. (2015). Acta Cryst. 71, 1455-1470.