Сравнение водородных связей в структурах белка, определенных методами ЯМР и РСА
Говоря о выходных, в Сети часто приводят картинку, изображенную на Рис. 1. Мои же выходные прошли в размышлениях над вопросом РСА vs. ЯМР, что, к слову, совершенно избавило меня от напитковой дилеммы, так как она всегда решалась в пользу правой части картинки (Рис. 1).

Главное отличие методов заключается в том, что объектом РСА является кристалл - статичная структура, а при ЯМР белок находится в растворе, сохраняя информацию о своих динамических свойствах. Разная информация о подвижности молекулы накладывает свой отпечаток на некоторые характеристики белка. Например, мы будем сравнивать методы расшифровки структуры по наличию водородных связей в разных участках структуры.
Главное действующее лицо в этом представлении - сериновая протеаза субтилизин. Структура этого белка была расшифрована и методом РСА (PDB ID: 1IAV), и методом ЯМР (PDB ID: 1AH2).
Параметры структур:
Разрешение РСА: 1.8 Å
Количество моделей ЯМР: 18
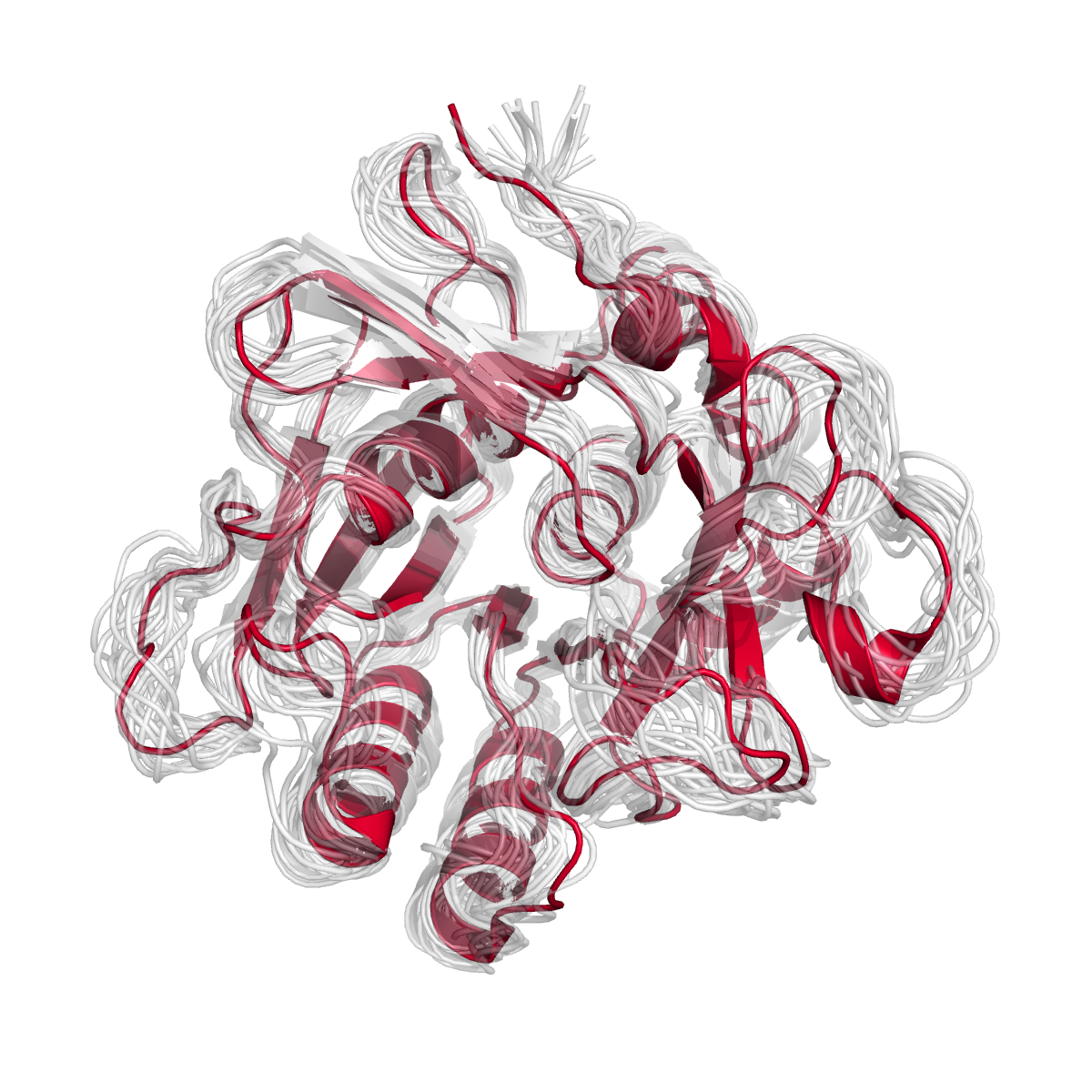
На Рис. 2 сопоставлены структуры субтилизина, полученные разными методами. Укладка структуры (ленточная модель) в целом совпадает по результатам РСА (темно-красный цвет) и ЯМР (все 18 моделей серого цвета, полупрозрачные). Наибольшие разночтения наблюдаются в свободных петлях и на N-конце (в верхней части изображения), что согласуется с большей подвижностью этих участков структуры в растворе.
Сопоставление структур было выполнено с помощью команды align:
align xray, nmr
Прозрачность ленточной модели была задана так:set cartoon_transparency, 0.7, nmr
Водородные связи
Прежде чем приступать к поиску водородных связей, нужно задать критерии того, что мы считаем водородной связью, так как в файле .pdb информации о связях нет.
Мы считаем, что водородная связь есть между электроотрицательными атомами донором и акцептором, если они расположены не дальше, чем на 3.5 Å друг от друга. Визуализировать водородные связи предлагалось следующей командой:
show lines, byres (set1 and (set2 around 3.5))
но у меня она не сработала, поэтому я визуализировала водородные связи с помощью команды dist:dist bond_name, donors, acceptors, 3.5, mode=2 #mode=2 - показывает контакты только между полярными атомами, очень полезно, если по каким-то причинам криво задал множества атомов доноров и акцепторов
При этом углы донор-акцептор-водород и акцептор-донор-водород не должны превышать 70 °. По умолчанию PyMOL не отображает водороды, поэтому величины углов можно прикинуть на глаз. Но для таких, как я, у кого плохо с воображением, в PyMOL заготовлена команда, добавляющая водороды в структуру:
h_add
Если еще и внутренний транспортир не настроен, то можно воспользоваться измерениями углов в интерактивном окне PyMOL:Wizard -> Measurement -> Angles (в меню справа в окне со структурой можно выбрать в Measurement Mode)
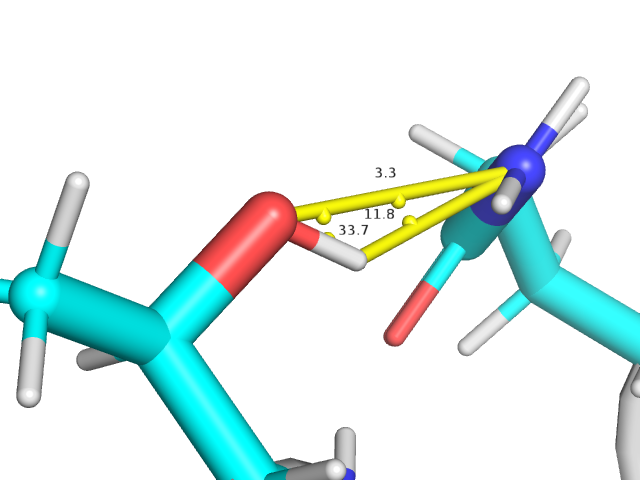
На Рис. 3 показан пример водородной связи, удовлетворяющей вышеупомянутым критериям. Длина связи - 3.3. Å. Угол донор-акцептор-водород равен 33.7 °, а угол акцептор-донор-водород - 11.8 °, таким образом, оба угла меньше 70 °.
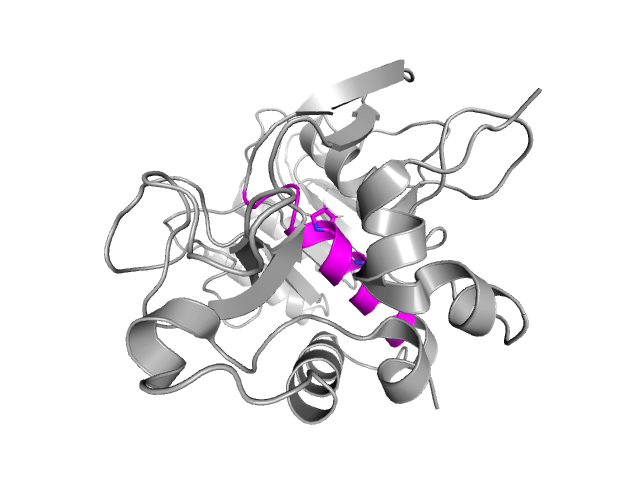
Для сравнения методов расшифровки было необходимо выбрать водородные связи в разных участках структуры, различающихся по удаленности от поверхности и по наличию вторичной структуры.
Были выбраны следующие связи (атомы записаны в порядке донор -> акцептор):
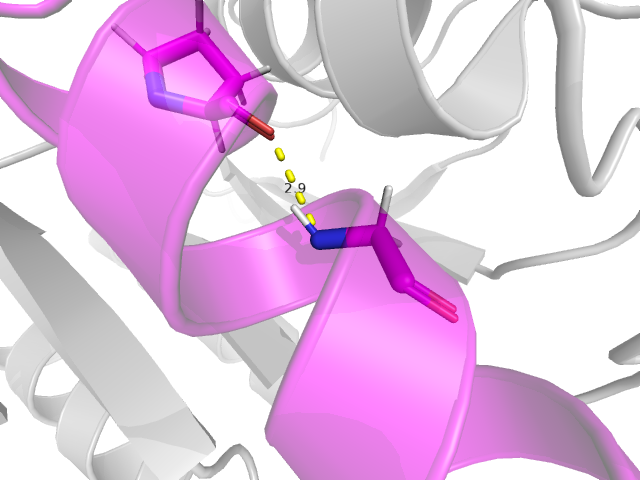
- Pro`225/N -> Gly`229/O - остовная водородная связь в альфа-спирали, которая находится в core структуры (Рис. 4)
- Asn`123/ND2 -> Ser`125/OG - связь между полярными группами в боковых цепях остатков (Рис. 5); эта связь наиболее удалена от поверхности глобулы, найти водородную связь непосредственно в core не удалось
- Gln`58/NE2 -> Thr`38/OG1 - связь между атомами боковых цепей остатков, расположенных в свободной петле на поверхности глобулы (Рис. 6)
Номера остатков заданы по структуре, расшифрованной с помощью РСА. Нумерация остатков в структурах РСА и ЯМР не совпадает, причем номера отличаются в ЯМР и РСА на разное количество остатков в разных местах структуры.
В Таблице 1 перечислены параметры, характеризующие связи: атом-донор, атом-акцептор, длина связи в структуре РСА, процент моделей ЯМР, в которых встречается эта связь, минимальная, максимальная и медианная длина связи в ЯМР.
Донор |
Акцептор |
len, Å (РСА) |
Встречаемость в моделях, % (ЯМР) |
min(len), Å (ЯМР) |
max(len), Å (ЯМР) |
med(len), Å (ЯМР) |
Pro`225/N |
Gly`229/O |
2.9 |
100 |
2.9 |
3.2 |
3.0 |
Asn`123/ND2 |
Ser`125/OG |
3.0 |
0 |
- |
- |
- |
Gln`58/NE2 |
Thr`38/OG1 |
3.3 |
5.56 |
2.6 |
2.6 |
2.6 |
На Рис. 4 показана водородная связь в остове альфа-спирали. Эта связь присутствует и во всех моделях ЯМР. Это согласуется с тем, что данная водородная связь принципиально важна для поддержания структуры, будучи расположенной в элементе регулярной вторичной структуры.
 |
 |
Водородная связь на Рис. 5 расположена на максимальном, которое только удалось найти, удалении от поверхности. Плоскость поверхности обозначена с левой стороны изображения, все, что справа, расположено внутри глобулы. В этом месте петля глубоко проникает внутрь глобулы, водородная связь образована остатком петли и остатком из бета-листа. Хоть в связи и задействована петля, все равно, на первый взгляд, может показаться, что такое глубинное проникновение может быть зачем-то нужно. Однако же нет, в 18 моделях ЯМР такая связь не встретилась ни разу, что свидетельствует о том, что в кристалле запечатлелось наименее характерное для этого участка молекулы состояние.
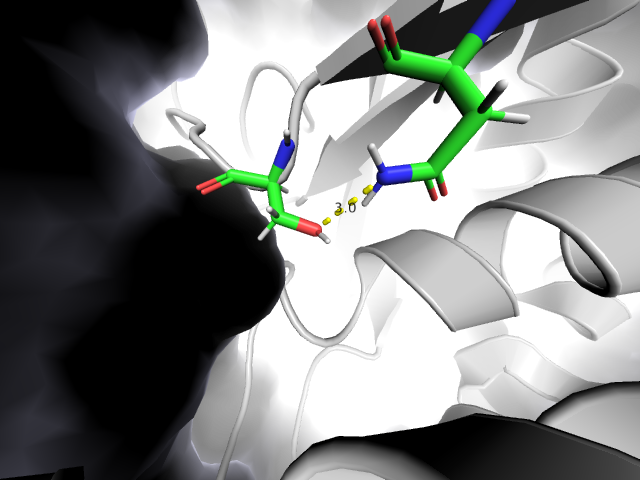 |
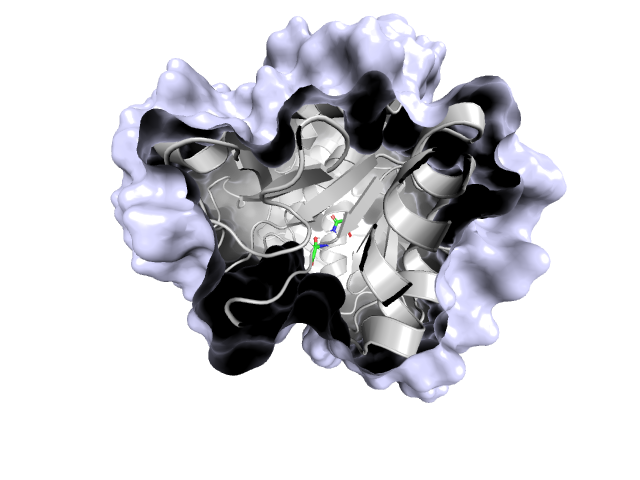 |
На Рис. 6 изображена водородная связь между атомами боковых цепей в свободной петле на поверхности. Свободная петля обладает большой подвижностью, что объясняет тот факт, что эта связь присутствует только в 1 из 18 моделей ЯМР.
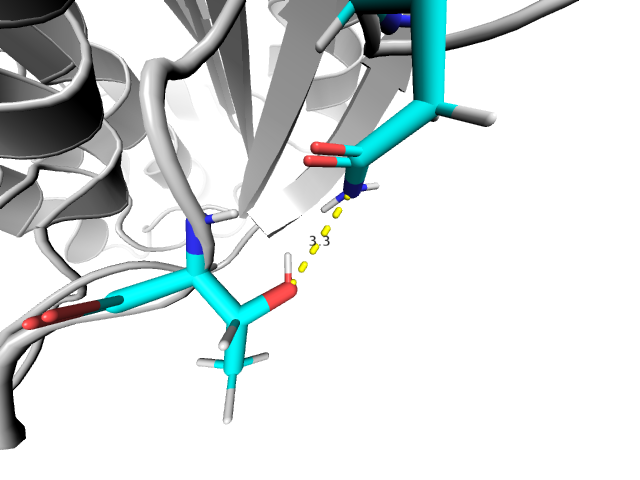 |
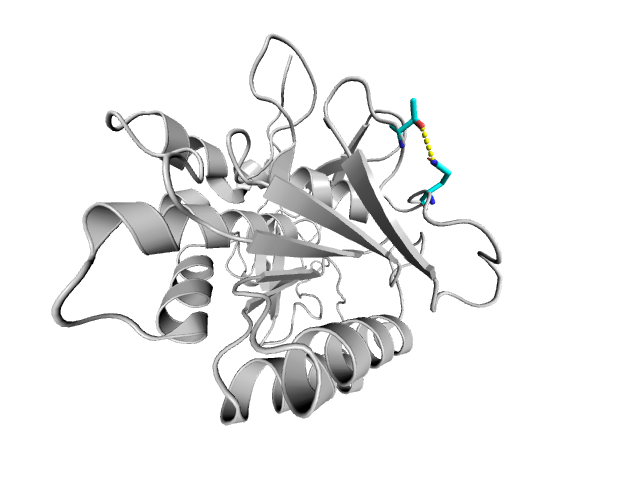 |
Чтобы поддержать волну празднования Дня народного единства, в качестве итога скажу, что так здорово, когда есть возможность проверить результаты РСА с помощью ЯМР и получить более полную информацию о подвижности отдельных структур белка.