Описание области контакта c лигандом ион цинка(II) в структуре предполагаемой Zn-зависимой пептидазы (идентификатор PDB 3C37)
Всего в структуре моего белка имеется два лиганда: дигидроксилэтиловый эфир (PEG, C4 H10 O3) и ион цинка. Так как эфир был разобран Сашей Погорельской (её отчёт можно посмотреть здесь), то я буду говорить о цинке.
В PDB-файле цинк так и обозначается - Zn. К сожалению, данных о функции этого лиганда конкретно в этом ферменте я не нашла, но в общем случае Zn является одним из самых "популярных" лигандов-металлов. Он стабилизирует структуру молекулы, образую "цинковые пальчики", участвует в каталитически реакциях всех классов ферментов и помогает образованию олигомеров. Я думаю, что в этой пептидазе цинк в основном выполняет стабилизирующую функцию, так как именно благодаря нему α-спирали собираются в компактный шар.
В данной пептидазе обнаружилось по одному цинку каждой цепи A и В. На рисунке 1, изображающем структуру белка, ионы цинка выделены фиолетовым.
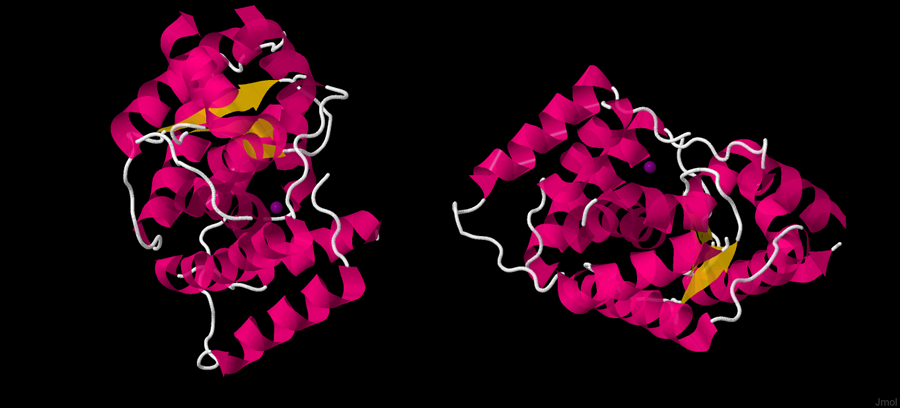
Рисунок 1. Структура пептидазы с выделенными цинками.
В белке ион образует связи с гистидином 106, гистидином 110, глутаминовой кислотой 162 и гистидином 208 (данные о связях цинка я взяла из PDB-файла моего белка - они были перечислены в графе Remark - COORDINATION ANGLES FOR METAL), тем самым связывая между собой противоположные концы молекулы, формируя устойчивую сферу. Связи цинка с белком представлены на рисунке 3, а на рисунке 2 можно посмотреть, каково длина этих связей. Так как цепи А и В симметричны, то на рисунке представлена только одна из них, а точнее, цепь В.
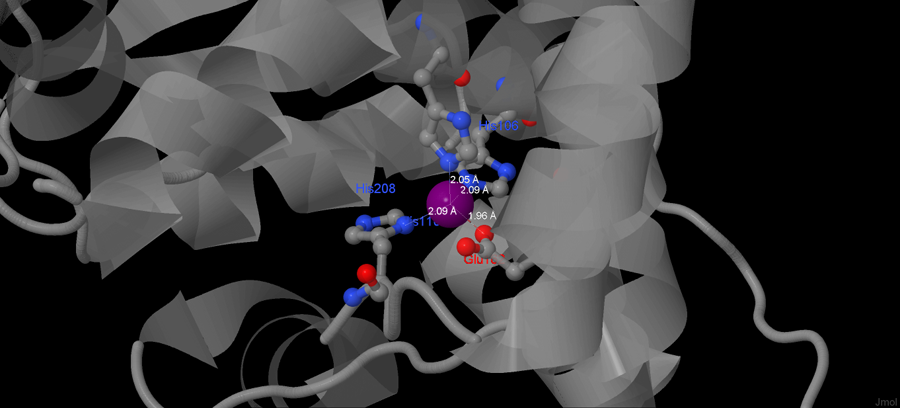
Рисунок 2. Длина связей цинка с аминокислотами в пептидазе.
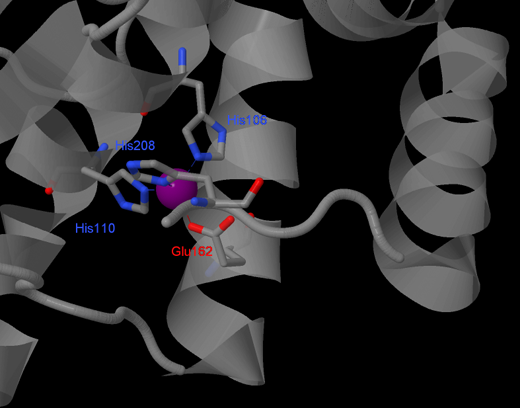
Рисунок 3. Связи цинка в пептидазе.
Чтобы получить данное изображение, нужно ввести в Jmol данный скрипт.
Дата последнего изменения: 17.04.2014
