Описание области контакта белка и лиганда SO42- в структуре YXIM
Лиганды в структуре YXIM
Молекула белка YXIM соединена с двумя лигандами - катионом Mn2+ и анионом SO42- (см. рис.1). Они достаточно малы по отношению к размеру белка (данные, полученные при измерениях молекул в JMol, приведены в таблице 1).
Таблица 1. Размеры белка YXIM и его лигандов
| Молекула | Размер | ||
| Å | нм | м | |
| Полипептидная цепь | 72,5 x 39,5 x 32,9 | 7,25 x 3,95 x 3,29 | 7,25*10-9 x 3,95*10-9 x 3,29*10-9 |
| Сульфат-ион | 2,4 | 0,24 | 2,4*10-10 |
| Ион маргнца | 0,8 | 0,08 | 8*10-11 |
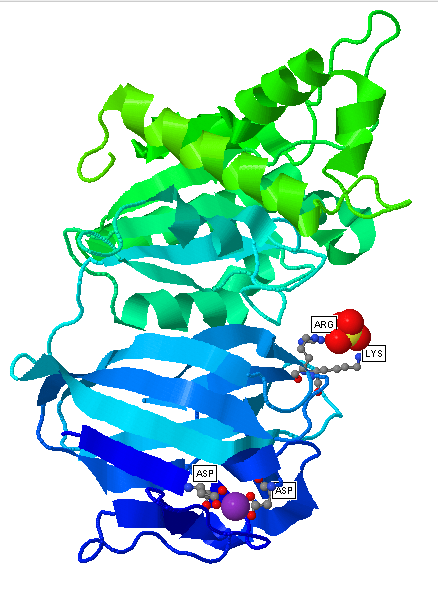
|
| Рис.1 Белок YXIM и его лиганды. Белок окрашен цветовым переходом от синего к зелёному (от N-конца к C-концу соответственно), фиолетовым - ион марганца, жёлтым - атом серы и красным - атомы кислорода. Аминокислотные остатки, взаимодействующие с лигандами, окрашены стандартными цветами и подписаны. Дополнительные карбоксильные группы остатков аспартата №19 и №65 (их атомы кислорода окрашены красным цветом) связываются с положительно заряженным ионом марганца, дополнительные аминогруппы остатков лизина №140 и аспарагина №100 (их атомы азота окрашены синим цветом) связываются с отрицательно заряженным сульфат-ионом. |
Белок YXIM по функции является эстеразой, но его конкретная функция ещё не выяснена. Невозможно точно сказать, играет ли присутствие сульфат-иона в белке какую-то роль или является артефактом.
Как и многие другие катионы металлов, Mn2+, скорее всего, является кофактором, косвенно влияет на форму активного центра фермента.
Анализ области контакта белка из структуры YXIM и лиганда SO42-
Среди лигандов белка YXIM наиболее сложным по строению является сульфат-ион (на рис.1 его атомы окрашены жёлтым и красным). Данный ион контактирует с аминокилотными остатками ARG100 и LYS140 (см. рисунки 2 и 3)*. Между атомами кислорода сульфат-иона и атомами азота аминогрупп боковых цепей аргинина и лизина образуется ионная связь, SO42- находится от аминокислотных остатков на расстоянии около 0,3 нм.
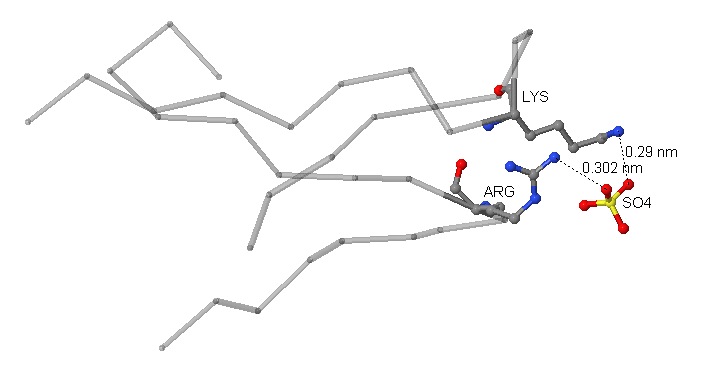
|
| Рис.2 Связь участка белка YXIM и сульфат-иона, 3D-модель. Лиганд и взаимодействующие с ним аминокислотные остатки окрашены стандартными цветами (углерод - серым, азот - синим, кислород - красным, сера - жёлтым), пунктиром обозначены наиболее вероятные связи, серыми полупрозрачными линиями - не участвующие в исследуемом взаимодействии участки цепи. . |
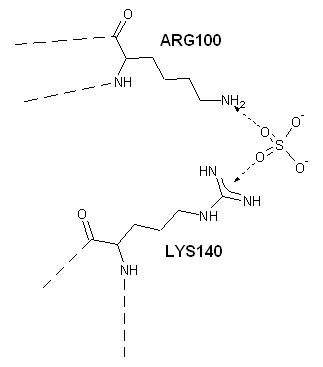
|
| Рис.3 Связь участка белка YXIM и сульфат-иона, схема. Наиболее вероятные связи обозначены пунктирными стрелками, пунктирными линиями обозначены части цепи белка, отходящие от аминокислотных остатков ARG100 и LYS140. |
* - получить данные изображения можно с помощью с помощью программы JMol такой последовательности команд
Проект генно-инженерного эксперимента с белком структуры YXIM
Белок YXIM связывает отрицательно зряженый лиганд SO42- остатками аргинина (№ 100) и лизина (№ 140) - остатками положительно заряженных аминокислот.
Предположим, нам необходимо, чтобы белок перестал связывать данный лиганд. Тогда нужно, чтобы оба аминокислотных остатка на позициях 100 и 140 не были заряжены положительно. Тогда мы можем заменить исходные аминокислоты на любые, кроме лизина, гистидина и аргинина.
Если же нам понадобится заменить аминокислоты так, чтобы белок продолжал связывать лиганд, мы можем использовать два пути.
- Заменить любой из остатков 100 и 140 на другую положительно заряженную аминокислоту (His, Arg, Lys))
- На одной из позиций оставить одну положительно заряженную аминокислоту (His, Arg, Lys), а на вторую поставить незаряженную или заряженную нейтрально (заряженная отрицательно будет отталкивать анион).
Во втором случае, лиганд будет связываться слабее, так как будет взаимодействовать только с одним аминокислотный остатком. Можем считать первый вариант более предпочтительным.
Обобщённые результаты представлены в таблице 2.
Таблица 2. Возможные замены аминокислот
| № | Задача эксперимента | Подходящая для замены аминокислота | ||
| на позицию 100 | на позицию 140 | |||
| 1 | Потеря белком способности связывать лиганд | Ala, Gly, Val, Ile, Leu, Pro, Ser, Thr, Cys, Met, Asp, Asn, Glu, Gln, Phe, Tyr, Trp | Ala, Gly, Val, Ile, Leu, Pro, Ser, Thr, Cys, Met, Asp, Asn, Glu, Gln, Phe, Tyr, Trp | |
| 2 | Сохранение белком способности связывать лиганд | Lys, His | Arg, His | |
| обо мне | семестры | заметки | ссылки |
| вернуться на главную | |||
