Остовные водородные связи в белке β-порфириназы из генома бактерии Zobellia galactanivorans
На рис.1 можно увидеть α-спирали моего белка.

Рис. 1. α-спирали белка β-порфириназы.
Рассмотрим самую большую из них(целых 6 аминокислот) подробнее(рис.2)
На ней выделены водородные связи, показаны атомы, их образующие. Удивительно то, что Jmol рассчитал, что у одного из атомов кислорода - две водородные связи. Так эти гипотетические связи одинаковы по длине, то точно утверждать, какая из них образуется в белке нельзя. Более того, возможно тут существует распределение, размытие этой связи в области, задаваемой гипотетическими.
Вычислим приблизительный шаг спирали с помощью средств Jmol- получим 5,6А( что приблизительно соответствует информации в Википедии). Спираль совершает где-то 1.6 витков, аминокислот - 6. Т.е в число аминокислотных остатков на один виток приблизительно равно 3.75(что также близко к информации к Википедии).
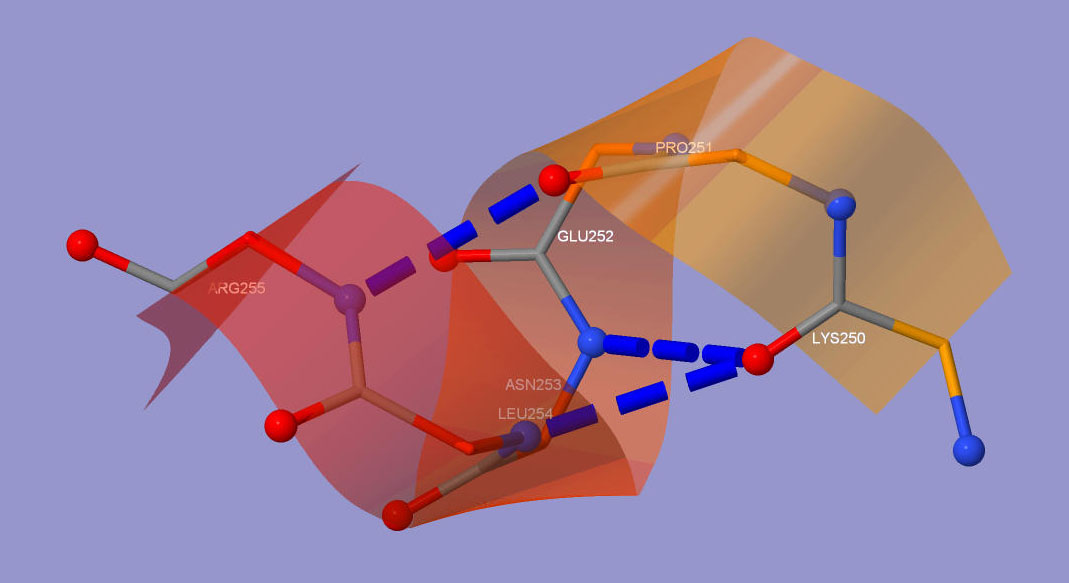
Рис. 2. Одна из α-спиралей белка β-порфириназы.
На следующем рисунке(рис.3) представлена одна из связей - между Arg255 и Pro251 более подробно. В данном случае акцептором является азот аргинина, акцептором - кислород пролина.
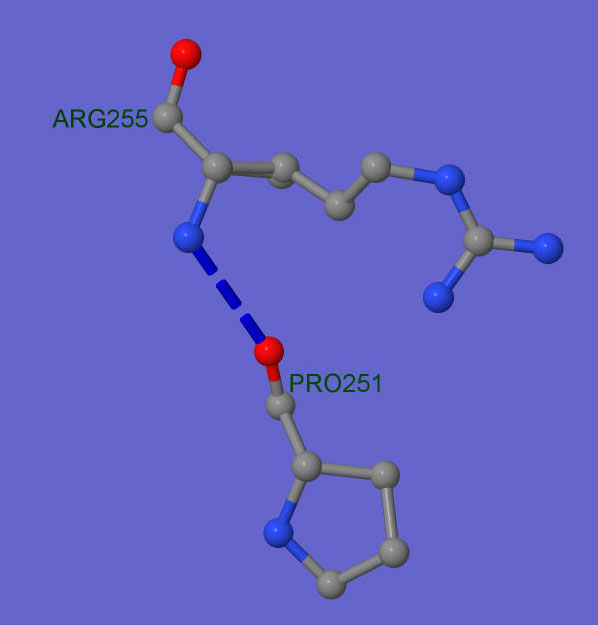
Рис. 3. Водородная связь в α-спирали
Остовный водородные связи в β-слоях можно увидеть на рис.4. Выделены начальный и конечный аминокислотные остатки. В составе β-слоя есть три тяжа, расположеные с чередованием параллельности-антипараллельности, окраска изменяется от начала до конца слоя от зеленой к светло-голубой( помог немного адаптированныймой скрипт)
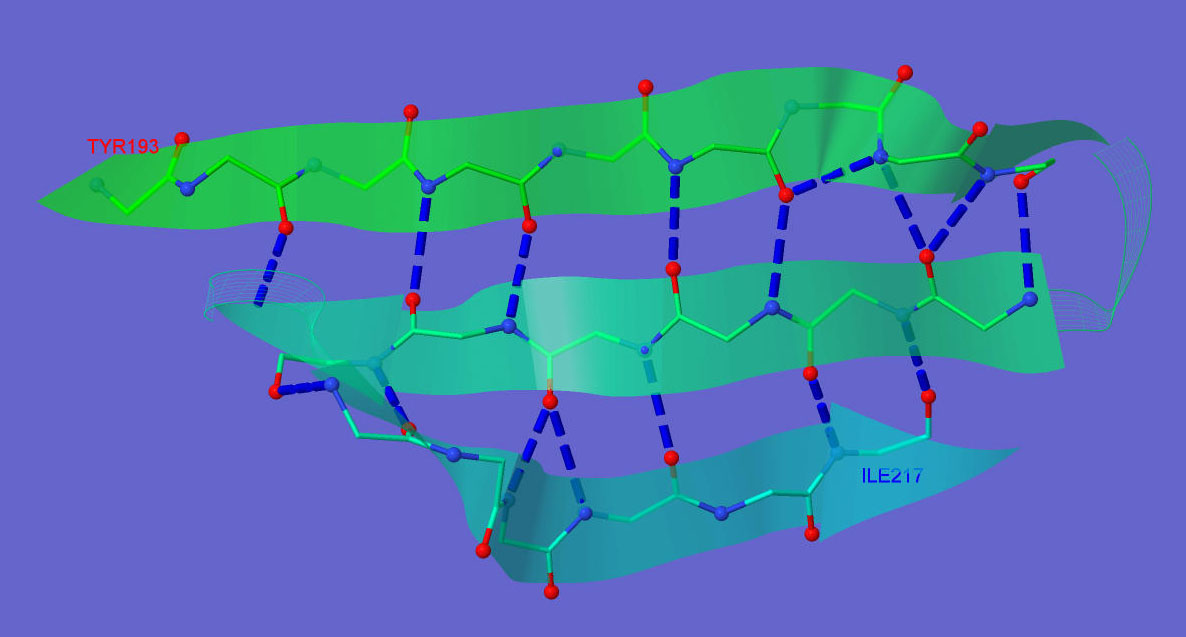
Рис. 4. Водородные связи в β-слое.
Более детально одна(точнее две) из водородных связей представлена на рис.5. Gly196 и Tyr208, если верить Jmol образуют две водородные связи, т.е азот каждого является донором в соответствующей водородной связи, а O - акцептором в другой.
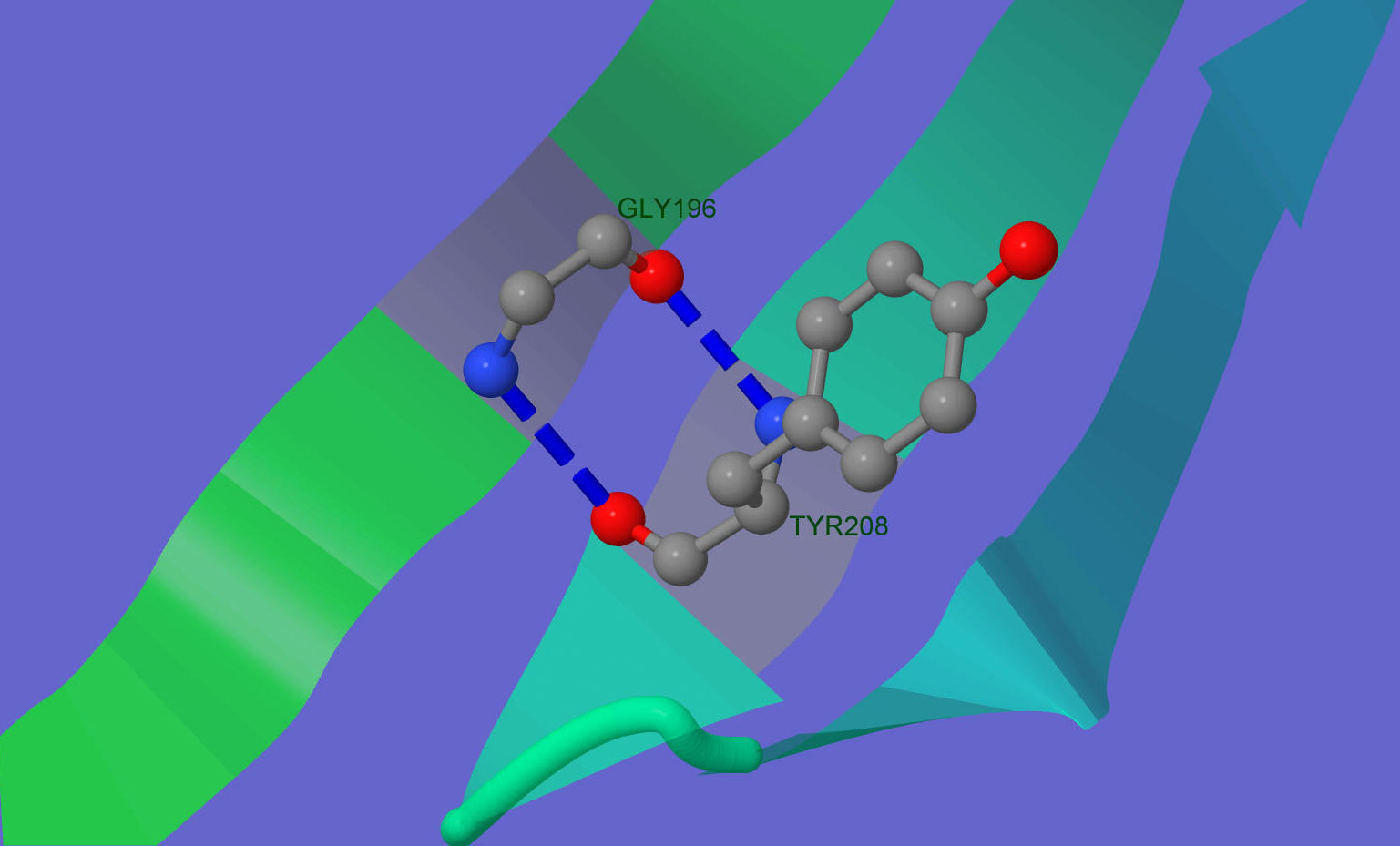
Рис. 5. Водородная связь в β-слое.
На рис.6 представлены β-шпильки и β-поворот. Интресно, что поворот формируется при помощи всего двух аминокислот -Pro202 и Asn203. Важно отметить, что аминокислоты Ser201 и Glu204 образуют между собой водородные связи(на рисунке не показано)
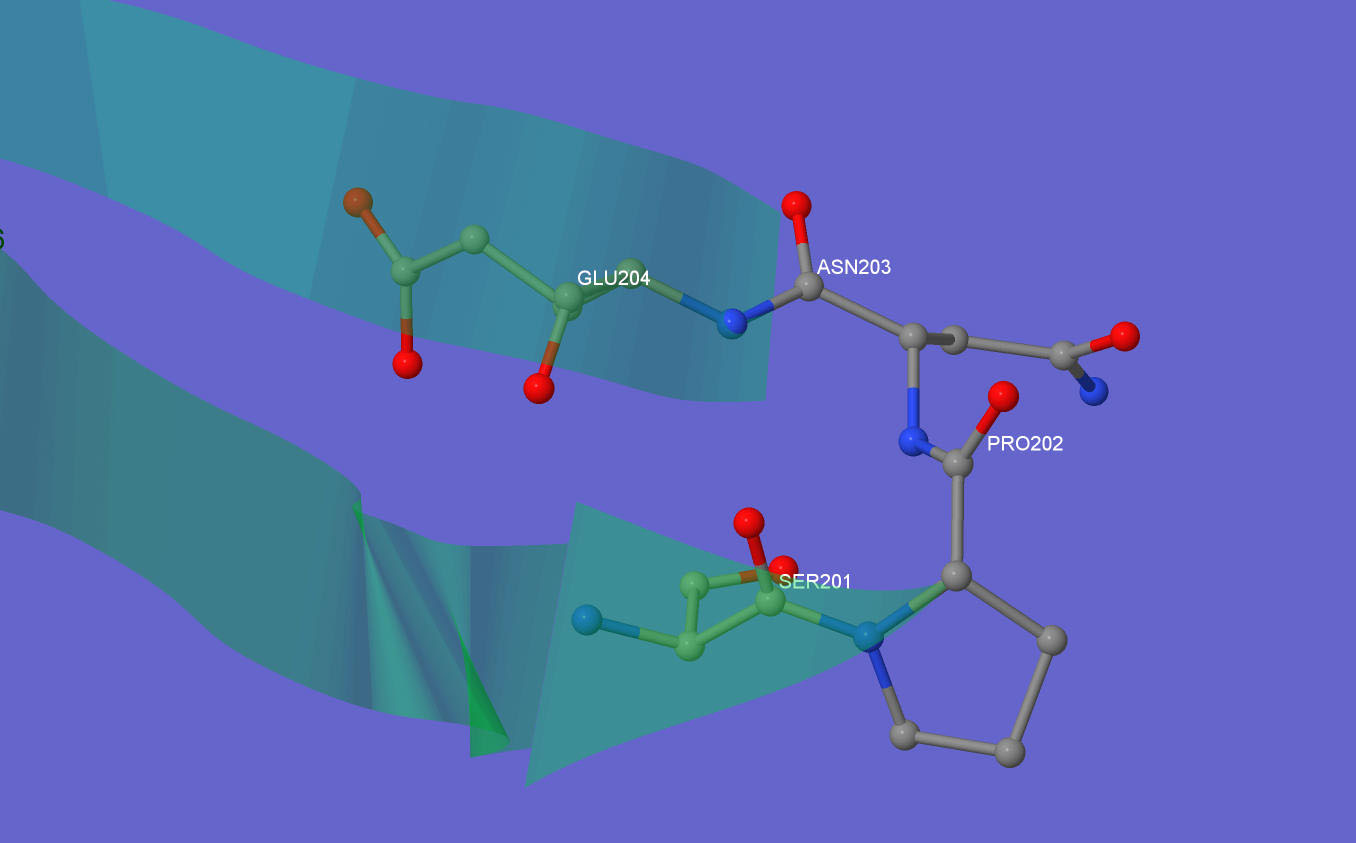
Рис. 6. β-шпильки и β-поворот в β-порфириназе.
Спасибо Ирине Хвень(http://kodomo.fbb.msu.ru/~partyhard/index.html) за подсказанные идеи.
