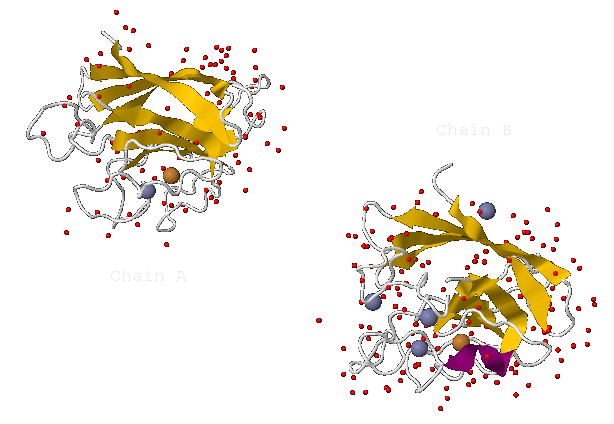
Лиганды в структуре 1XTM
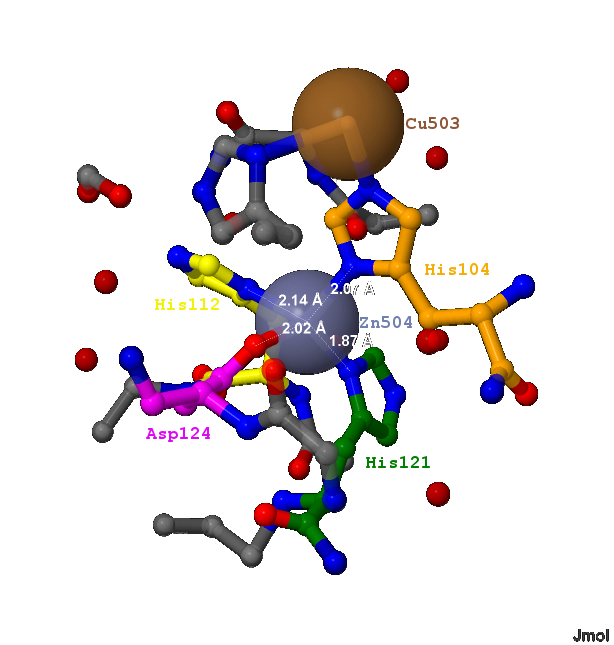
В белке 1XTM не содержится органических лигандов. Однако в его молекуле координируются атомы 2-х металлов (представлено на рис.1):
- В А-цепи 1 ион меди Cu2+ (503) и 1 ион цинка Zn2+ (504)
- В B-цепи 1 ион меди Cu2+ (500) и 4 иона цинка Zn2+ (501,502,505,506)
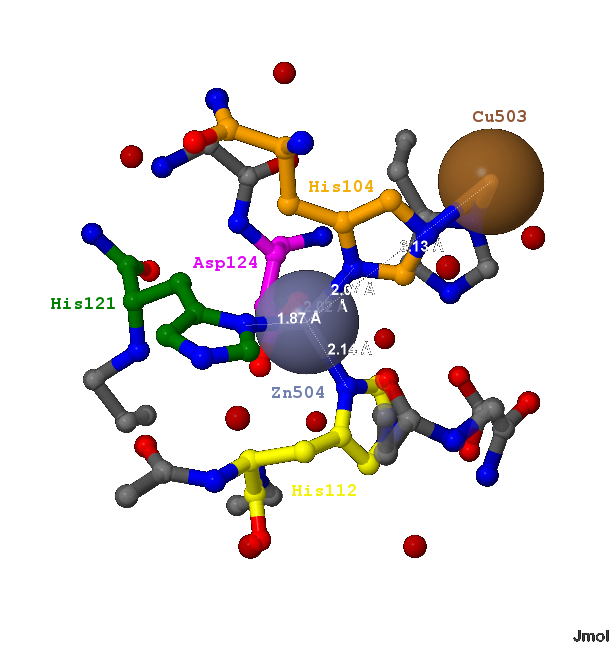
- Атомом азота ND1 боковой группы гистидина (His104). Длина связи - 2.07 Å;
- Атомом азота ND1 боковой группы гистидина (His112). Длина связи - 2.14 Å;
- Атомом азота ND1 боковой группы гистидина (His121). Длина связи - 1.87 Å;
- Атомом кислорода OD2 боковой группы аспартата (Asp124). Длина связи - 2.02 Å;
Размеры лигандов:
| Ион | Радиус иона | ||
| Å | нм | м | |
| Cu2+[1] | 0,72 | 0,072 | 7,2*10-11 |
| Zn2+[2] | 0,74 | 0,074 | 7,4*10-11 |
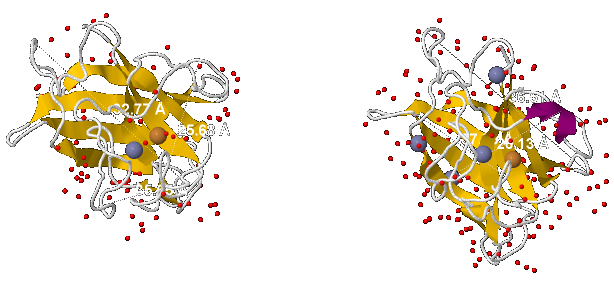
Белок имеет вид сферы, сплюснутой по одной из осей (показано на рис.2):
Если в одной плоскости белок имеет в диаметре длину 35-36 Å (3,5-3,6 нм, 3.5*10-9 - 3.6*10-9 м), в другой - 33-37 Å (3,3-3,7 нм, 3.3*10-9 - 3.7*10-9 м), то в третьей всего 25-26 Å (2,5-2,6 нм, 2.5*10-9 - 2.6*10-9 м).
Белок 1XTM предположительно является супероксиддисмутазо-подобным белком [3]. А так как в нём содержатся атомы меди и цинка, то он скорее всего является Cu,Zn-СОД (СОД - супероксиддисмутаза). Известно, что СОД представляют собой антиоксидантные ферменты [4], т.е. защищают клетку от высокотоксичных активных форм кислорода. Значит, белок 1XTM обладает схожими функциями. Тогда атомы металлов являются частью молекулы, т.е. кофакторами белка (но никак не его субстратом).
Анализ области контакта белка из структуры PDB 1XTM и лиганда ZINC ION в цепи А
В предыдущем разделе лиганд ZINC ION представлен на рис.1-2 в виде серой сферы в цепи А.
Лиганд Zinc ion является ионом Zn2+ (504) в А-цепи белка 1XTM. Он контактирует с боковыми цепями 4-ёх аминокислот (показано на рис.3-5), а именно с:
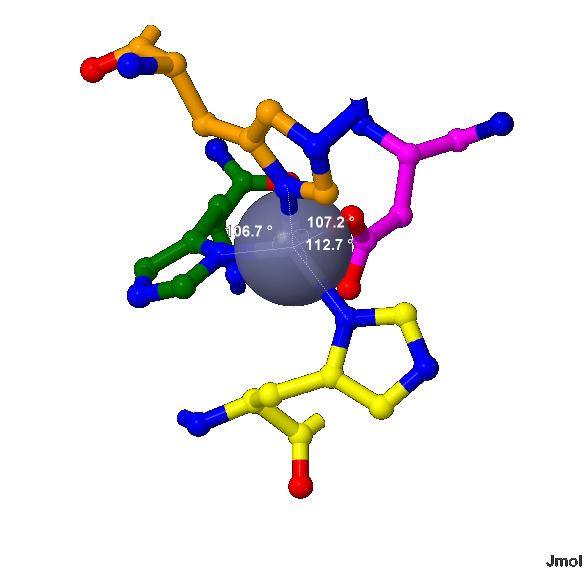
Ион Zn2+ находится в центре фигуры, напоминающую тетраэдр, вершинами которого являются атомы, с которыми контактирует лиганд (видно на рис.6-7). Как уже отмечалось, лиганд Zinc ion является одним из кофакторов белка 1XTM.
Следует отметить, что Zinc ion находится всего в 6.13 Å от иона Cu2+ (503), который контактирует с тем же гистидином His104, но через атом азота NE2.
Изображения, представленные на рис.1 и 4, можно последовательно получить с помощью скрипта  для консоли JMol.
для консоли JMol.
Проект генно-инженерного эксперимента с белком из структуры 1XTM
Для того чтобы белок связывал лиганд Zinc ion, т.е. ион Zn2+, необходимо стабилизировать его со всех сторон, что вполне достигается при заключении атома цинка в центр тетраэдра.
Сохранение способности связывать лиганд Zinc ion при точечной мутации
1. При точечной мутации в гене возможно точное воспроизведение белка на рибосоме без изменений в его структуре. Это происходит при замене нуклеотида в кодоне на другой, не изменяющий его "смысл".
Таким образом, т.к. аспартат кодируется кодонами [5] GAU и GAC, то возможна замена третьего нуклеотида U на C и наоборот.
2. Но возможна замена кодона и на тот, который кодирует другую аминокислоту, но с похожими свойствами. Глутамат, как и аспартат, имеет вторую карбоксильную группу -COOH, но отстоящую на 1 дополнительный атом углерода от α-атома С. Поэтому, если заменить аспартат (GAU, GAC) на глутамат (GAA, GAG): замена третьего нуклеотида U,C → A,G, то, скорее всего, белок сохранит способность связывать Zinc ion.
3. Гистидин, который также взаимодействует с Zinc ion, как и аспартат кодируется двумя кодонами - CAU и CAC. То есть при замене третьего нуклеотида U → C белок не изменится.
4. Гистидин стабилизирует Zinc ion благодаря наличию атома N+. Лизин (AAA, AAG) и аргинин (CGU, CGC, CGA, CGG, AGA, AGG) тоже содержат атом N+ почти на том же месте, что и в гистидине. Значит, при замене CAU, CAC → AAA, AAG, CGU, CGC, CGA, CGG, AGA, AGG белок, возможно, сохранит лиганд Zinc ion. Однако заменой всего 1 нуклеотида из гистидина возможен переход только в аргинин: CAU→CGU, CAC→CGC. Следует учесть, что гистидин His104 связан сразу с 2 лигандами, благодаря наличию гетероциклического кольца с двумя азотами. Поэтому его замена на другую аминокислоту скорее всего приведёт к потере одного из ионов.
Потеря способности связывать лиганд Zinc ion при точечной мутации
Потерять способность связывать лиганд Zinc ion намного проще, ведь если убрать хотя бы одну вершину тетраэдра, то ион уже будет выпадать из него. Поэтому любые изменения, кроме описанных в предыдущем пункте будут вызывать требуемый результат.