Данный белок входит в состав капсида ВИЧ-1 (Вирус иммунодефицита человека первого типа). Этот вирус способен привести к синдрому приобретённого иммунодефицита человека (СПИД), если его не лечить. В отличие от некоторых других вирусов, человеческое тело не способно полностью избавиться от ВИЧ, даже с лечением. ВИЧ-1 демонстрирует уникальную возможность проникать в неделящиеся клетки. Это происходит благодаря капсиду. Пептид Nup153, находящийся в комплексе с данным белком открывает комплекс ядерных пор для ядерной транслокации ВИЧ-1 в неделящиеся клетки.

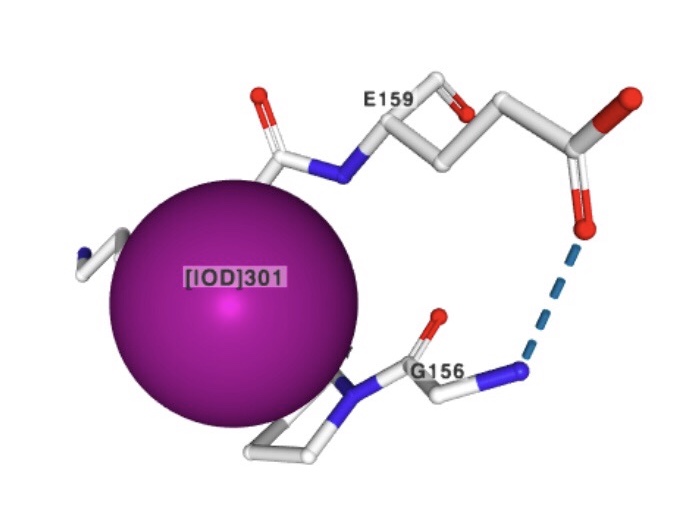
1) Йодид ион
Название по IUPAC: Iodide ion
Брутто-формула: I-
Молярная масса: 126.904 г/моль
PubChem CID: 30165
Ион йода может функционировать как антиоксидант. Благодаря его способности к восстановлению,
он может устранять активные формы кислорода, такие как перекись водорода.
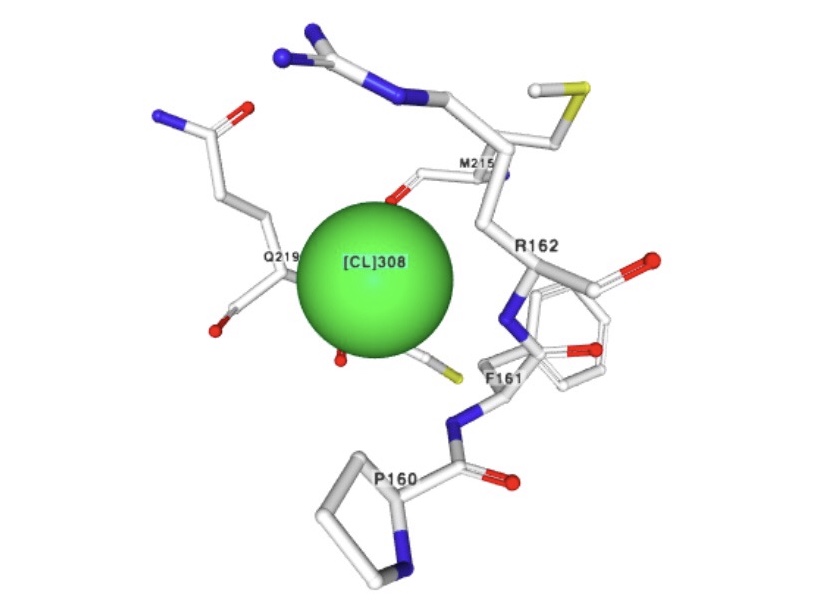
2) Хлорид ион
Название по IUPAC: Chloride ion
Брутто-формула: Cl-
Молярная масса: 35.45 г/моль
PubChem CID: 312
Ионы хлора образуют внутренний слой, прилегающий к поверхности капсида. Точная биологическая
роль, которую играет данный ион в капсиде – неизвестна, так как он может быть замещён на другой ион, находящийся в цитоплазме.
Если карбоксильная группа одной L-аминокислоты ацилирует аминогруппу другой аминокислоты, то образующуюся амидную связь называют пептидной. Петидные связи в белках плоские и представлены практически исключително транс-изомерами. Данные связи отвечают за образование первичной структуры. Так в любом белке количесвто пептидных связей велико, здесь представлено изображение одной из пептидных связей молекулы. Место контакта аминокислот увеличено в размерах.
6aya.jpg)
Наличия остатков цистеина дает возможность образования дисульфидных мостиков - дополнительных факторов стабилизации белковой структуры. В молекуле "6aya" был найден один дисульфидный мостик, который на изображении окрашен в желтый цвет.
6aya.jpg)
В рассматриваемой биомолекуле (PDB 6aya) во вторичной структуре имеются как альфа-спирали, так и бета-тяжи. Соответственно, имеется множество водородных связей, удерживающих структуры. Ниже приведены данные о водородных связях нашей молекулы:

| Таблица 1. Beta-sheets. | |||
|---|---|---|---|
| # | Имена атомов | Значение |
| 1 | O([VAL]3:A - N([VAL]11:A | 2.84 Å |
| 2 | N([VAL]3:A - O([VAL]11:A | 3.00 Å |
| Таблица 2. Alpha-helix. | |||
|---|---|---|---|
| # | Имена атомов | Значение |
| 1 | O([GLU]212:A - N([THR]216:A | 2.92 Å |
| 2 | O([LEU]211:A - N([MET]215:A | 2.89 Å |
| 3 | O([THR]210:A - N([MET]214:A | 3.09Å |

| Таблица 3. 3-10 helix. | |||
|---|---|---|---|
| # | Имена атомов | Значение |
| 1 | O([ILE]150:A - N([ILE]153:A | 3.61 Å |
| 2 | O([SER]149:A - N([ASP]152:A | 3.13 Å |
Здесь приведены только длины водородных связей, т.к. в PDB файле рассматриваемого белка 6aya отсутствуют протоны, то измерить величины углов не представляется возможным. Однако данные о длине водородных связей для каждого элемента вторичной структуре совпадают с теоретическими. Интересно, что в рассматриваемой биомолекуле присутствуют не только альфа-спирали и бета-тяжи, но и 3-10 спирали.
Иогенные группы (остатки глутаминовой, аспарагиновой кислот; гистидина, лизина и аргинина)участвуют в ионных взаимодействиях, образуя так называемые солевые мостики.
Во взаимодействуют участвуют отрицательно заряженные карбоксильные группы радикалов "Asp" и "Glu" кислот и положительно заряженные группы радикалов "Lys","Arg" или "His" кислот. Эти взаимодействия возможны как внутри белка, так и с другими молекулами.
Из аминокислот, способных потенциально образовывать ионные связи, были выбраны те представители, радикальные группы которых находились на расстоянии не более 4Å.
6aya.jpg)
1)Поиск контакта
В JMOL были выделены все гидрофобные остатки (фиолетовым цветом) и остатки Tyr и Phe (так как они довольно крупные - зелёным цветом). Далее был выбран остаток [Tyr]130:A, т.к. он лучше всего удовлетворял условиям поиска (“гидрофобный остаток, боковая цепь которого упакована в гидрофобное окружение”)
2)Гидрофобное ядро
Остаток [Tyr]130:A практически полностью покрыт атомами, находящимися от него на расстоянии не более 6А. В его гидрофобной оболочке есть “дырка”, в которую может поместиться 1 молекула воды.
При помощи инструмента программы JMOL были проведены измерения расстояний между соседними ковалентно несвязанными атомами, находящимися от остатка [Tyr]130:A на расстоянии не более 6А. В таблице 4 приведены результаты. В третьем столбце находятся расстояния, полученные с помощью инструмента JMOL. Но если пересчитать эти расстояния учитывая ван-дер-ваальсовы радиусы атомов, то получаются следующие данные(приведены в четвёртом столбце таблицы 4), это необходимо сделать, чтобы узнать, где может поместится молекула воды.
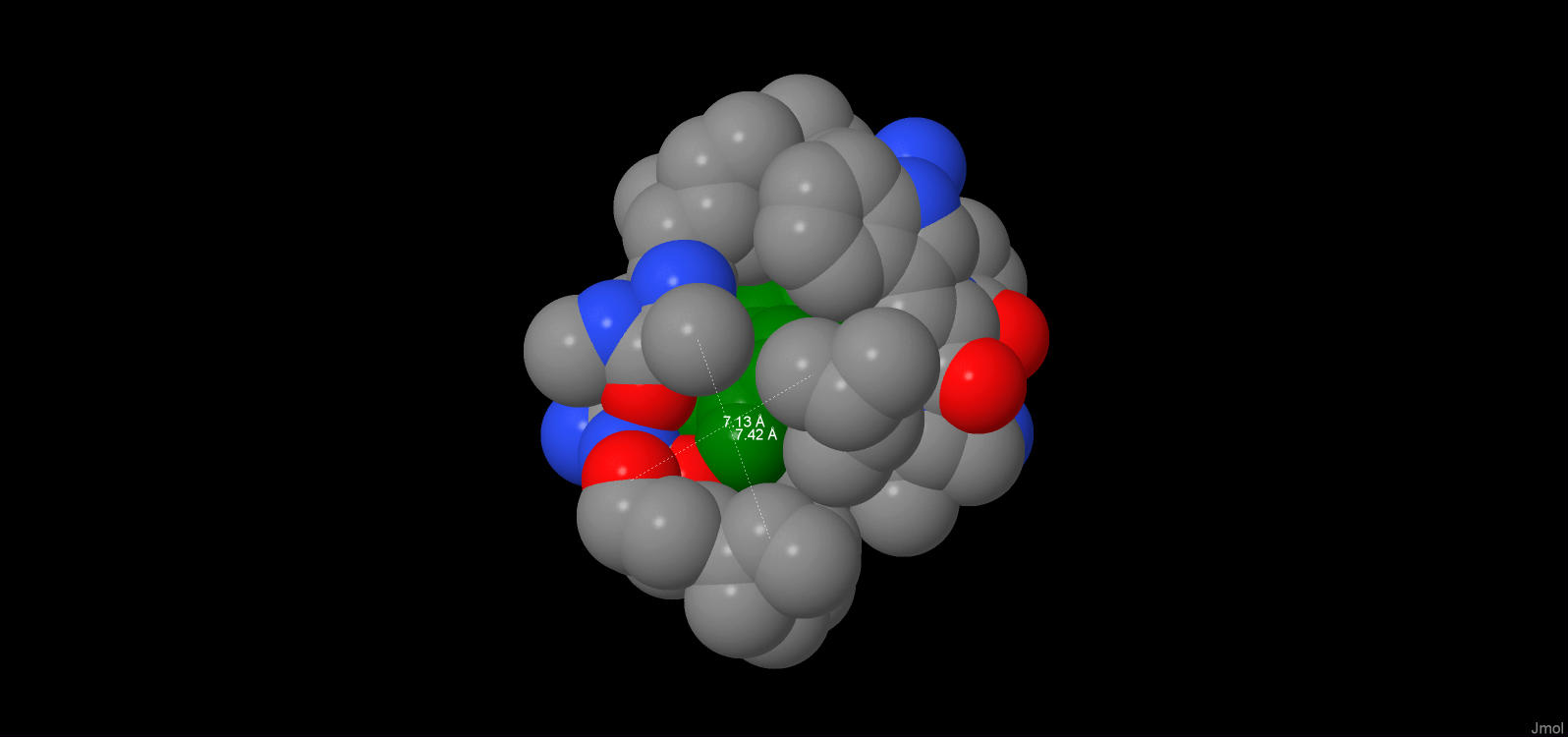
| Таблица 4. | |||
|---|---|---|---|
| Атом 1 | Атом 2 | Расстояние между центрами атомов, A | Расстояние с учетом ван-дер-ваальсовых радиусов, A |
| [ILE]134:A.CG2 | [LEU]52:A.CD2 | 6.36 | 2.66 |
| [THR]48:A.C | [GLY]127:A.CA | 4.69 | 0.99 |
| [LEU]52:A.O | [ILE]134:A.CG2 | 6.47 | 3.22 |
| [LEU]52:A.CA | [ILE]134:A.CD1 | 4.74 | 1.04 |
| [LEU]56:A.CD1 | [ILE]73:A.CD1 | 4.21 | 0.51 |
| [ILE]73:A.CG1 | [TRP]133:A.O | 4.94 | 1.69 |
| [VAL]126:A.CB | [ILE]104:A.CA | 4.7 | 1.0 |
| [PRO]49:A.CG | [ILE]104:A.C | 4.33 | 0.64 |
| [ALA]105:A.CB | [PHE]1417:B.CD1 | 7.42 | 3.72 |
| [PHE]1417:B.O | [ILE]73:A.CG2 | 7.13 | 3.88 |
На основании таблицы 4 рассчитываем среднее расстояние между ковалентно не связанными атомами = 1.93А, т.е. молекула воды там не поместится. Как уже было сказано в п.1, в гидрофобной оболочке имеется только одно место, где расстояния между атомами достаточно для того, чтобы там поместилась молекула воды (считаем, что молекула воды по размеру примерно равна атому кислорода). Т.е: 7.13-(1.85+1.4)=3.88А и 7.42-(1.85+1.85)=3.72А. Диаметр атома кислорода считаем равным 2.8А. Действительно, молекула H2O помещается.