Данний білок входить до складу капсида ВІЛ-1 (Вірус імунодефіциту людини першого типу). Цей вірус здатен викликати сіндром набутого імунодефіциту людини, якщо його не лікувати. На відміну від декількох інших вірусів, тело людини не може повністю позбудуватися його навіть із лікуванням. ВІЛ-1 демонструє унікальну можливість проникати в неделящиеся клітини. Це відбувається завдяки капсиду. Пептид Nup153, що знаходиться в компелексі з даним білком відкриває комплекс ядерних пір для ядерної транслокціі ВІЛ-1 в неделящиеся клітини.

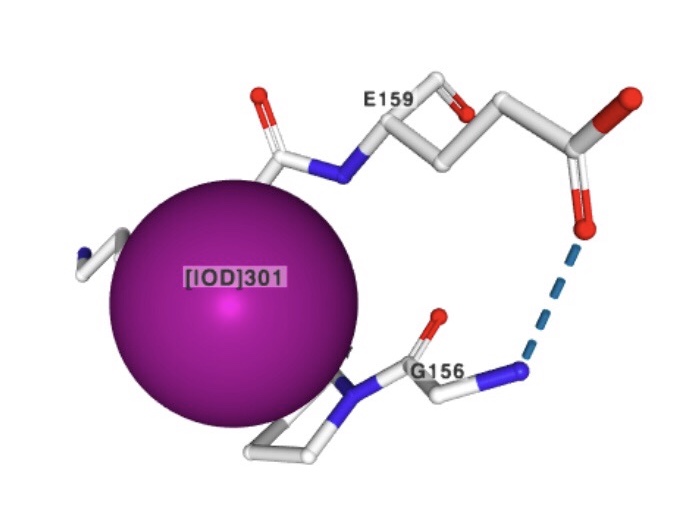
1) Йодид іон
Назва за IUPAC: Iodide ion
Брутто-формула: I-
Молярна маса: 126.904 г/моль
PubChem CID: 30165
Iон йоду може функціонувати як антиоксидант. Завдяки його здатності до відновлення,
вiн може усувати активні форми кисню, такі як перекис водню.
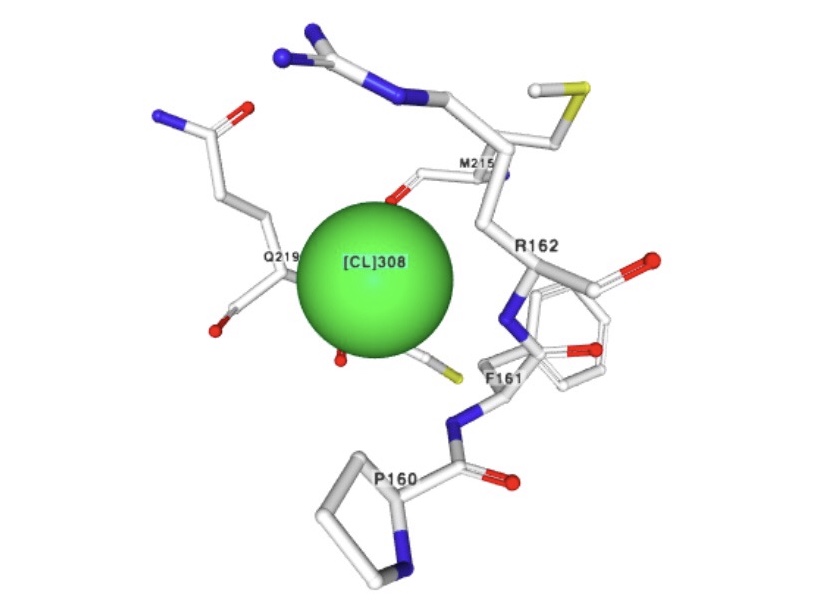
2) Хлорид іон
Назва за IUPAC: Chloride ion
Брутто-формула: Cl-
Молярна маса: 35.45 г/моль
PubChem CID: 312
Іони хлору утворюють внутрішній шар, прилеглий до поверхні капсида. Точна біологічна
роль, яку відіграє цей іон в капсиді - невідома, так як він може бути замінений на інший іон, що знаходиться в цитоплазмі.
Якщо карбоксильная група однієї L-амінокислоти ацилує аминогруппу іншої амінокислоти, то утворюється амидний зв'язок який називають пептидним. Петідни зв'язки у білках плоскі та представлені майже винятково транс-ізомерами. Дані зв'язки відповідають за утворення первинної структури. Так в будь-якому білку кількість пептидних зв'язків велика, тут представлено зображення однієї з пептидних зв'язків молекули. Місце контакту амінокислот збільшено у розмірах.
6aya.jpg)
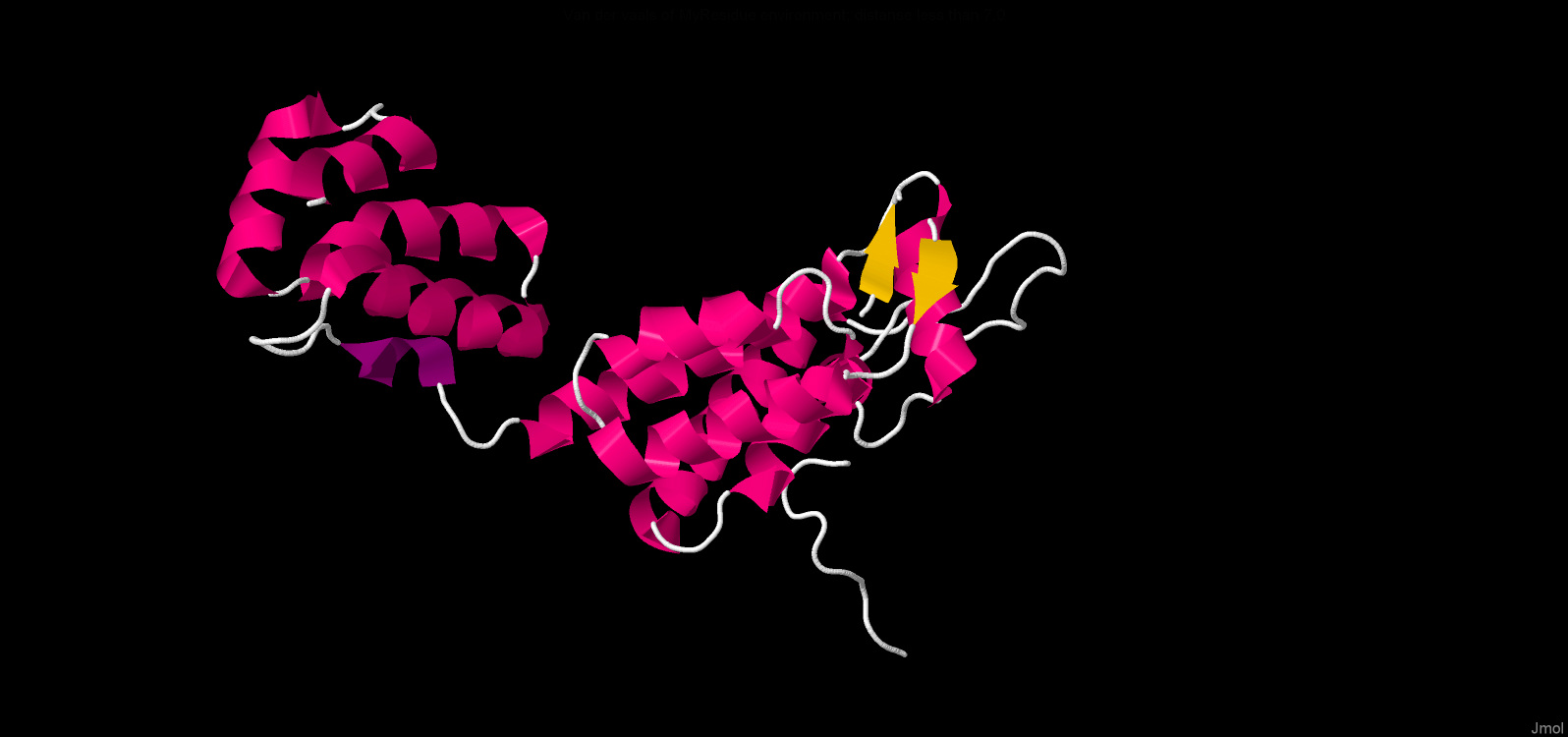
Наявності залишків цистеїну дає можливість утворення дисульфідних містків - додаткових факторів стабілізації білкової структури. У молекулі "6aya" був знайдений один дисульфідний місток, який на зображенні забарвлений у жовтий колір.
6aya.jpg)
У розглянутій біомолекулі (PDB 6aya) у вторинній структурі є як альфа-спіралі,
так і бета-тяжі. Тобто є безліч водневих зв'язків, що утримують структури.
Нижче наведені дані про водневі зв'язки нашої молекули:

| Таблица 1. Beta-sheets. | |||
|---|---|---|---|
| # | Iмена атомів | Значення |
| 1 | O([VAL]3:A - N([VAL]11:A | 2.84 Å |
| 2 | N([VAL]3:A - O([VAL]11:A | 3.00 Å |
| Таблица 2. Alpha-helix. | |||
|---|---|---|---|
| # | Iмена атомів | Значення |
| 1 | O([GLU]212:A - N([THR]216:A | 2.92 Å |
| 2 | O([LEU]211:A - N([MET]215:A | 2.89 Å |
| 3 | O([THR]210:A - N([MET]214:A | 3.09Å |

| Таблица 3. 3-10 helix. | |||
|---|---|---|---|
| # | Iмена атомів | Значення |
| 1 | O([ILE]150:A - N([ILE]153:A | 3.61 Å |
| 2 | O([SER]149:A - N([ASP]152:A | 3.13 Å |
Тут наведені лише довжини водневих зв'язків, тому що в PDB файлі розглянутого білка (6aya) відсутні протони. Тобто виміряти величини кутів не представляється можливим. Однак дані про довжину водневих зв'язків для кожного елемента вторинної структурі збігаються з теоретичними. Цікаво, що в розглянутій біомолекулі присутні не тільки альфа-спіралі та бета-тяжі, але й 3-10 спіралі.
Іогені групи (залишки глутамінової, аспарагінової кислот; гистидина, лізину і аргініну) беруть участь в іонних взаємодіях, утворюючи так звані сольові містки.
У взаємодіі беруть участь негативно заряджені карбоксильні групи радикалів "Asp" і "Glu" амінокислот і позитивно заряджені групи радикалів "Lys", "Arg" або "His" амінокислот. Ці взаємодії можливі як всередині білка, так і з іншими молекулами.
З амінокислот, здатних потенційно утворювати іонні зв'язки, були обрані ті представники, радикальні групи яких знаходилися на відстані не більш 4Å.
6aya.jpg)
1)Пошук контакту
В JMOL були виділені всі гідрофобні залишки (фіолетовим кольором) та залишки Tyr і Phe
(Так як вони досить великі - зеленим кольором). Далі був обраний залишок [Tyr] 130:A,
тому що він найкраще задовольняв умовам пошуку ("гідрофобний залишок, бічний ланцюг
якого упакован у гидрофобне ядро )
2)Гидрофобне ядро
Залишок [Tyr] 130: A практично повністю покритий атомами, що знаходяться від нього на
відстані не більше 6А. У його гидрофобной оболонці є "дірка", в яку може поміститися 1 молекула води.
Також були проведені вимірювання відстаней між сусідніми ковалентно непов'язаними
атомами (змінити) .У таблиці 3 (distancemeasurements (table)) наведені результати вимірювань.
(Відстань між центрами атомів). При перерахунку відстаней з урахуванням ван дер Ваальсових
радіусів отримуємо наступні результати:
| Таблица 4. | |||
|---|---|---|---|
| # | Відстань між центрами атомів, A | Відстань з урахуванням Ван дер Ваальсових радіусів, A | |
| [ILE]134:A.CG2 | [LEU]52:A.CD2 | 6.36 | 2.66 |
| [THR]48:A.C | [GLY]127:A.CA | 4.69 | 0.99 |
| [LEU]52:A.O | [ILE]134:A.CG2 | 6.47 | 3.22 |
| [LEU]52:A.CA | [ILE]134:A.CD1 | 4.74 | 1.04 |
| [LEU]56:A.CD1 | [ILE]73:A.CD1 | 4.21 | 0.51 |
| [ILE]73:A.CG1 | [TRP]133:A.O | 4.94 | 1.69 |
| [VAL]126:A.CB | [ILE]104:A.CA | 4.7 | 1.0 |
| [PRO]49:A.CG | [ILE]104:A.C | 4.33 | 0.64 |
| [ALA]105:A.CB | [PHE]1417:B.CD1 | 7.42 | 3.72 |
| [PHE]1417:B.O | [ILE]73:A.CG2 | 7.13 | 3.88 |
На підставі таблиці 4 розраховуємо середню відстань між ковалентно не пов'язаними атомами = 1.93А, тобто молекула води там не поміститься. Як вже було сказано в п.1, в гидрофобній оболонці є тільки одне місце, де відстані між атомами досить для того, щоб там помістилася молекула води (вважаємо, що молекула води за розміром приблизно дорівнює атому кисню). Тобто: 7.13- (1.85 + 1.4) = 3.88А і 7.42- (1.85 + 1.85) = 3.72А. Діаметр атома кисню вважаємо рівним 2.8А. Молекула H2O дійсно поміщається.