|
|
Исследование ДНК-белковых взаимодействий в структуре комплекса триптофанового репрессора и палиндромного фрагмента ДНК.
- Краткое описание структуры в файле 1TRO.pdb В файле приведены координаты атомов следующих молекул:
- Белок - триптофановый репрессор, состоящий из цепей: A, C, E, G
- Фрагмент молекулы ДНК DNA (5'-D(*TP*GP*TP*AP*CP*TP*AP*GP*TP*TP*AP*AP*CP*TP*AP*GP*TP*AP*C)-3') состоящий из 4 цепей I, J, K, L
Белок был выделен из Eschrichia coli штамм W3110, фрагмент ДНК искусственно синтезирован.
Для исследования были выбраны
цепи E,G белка и цепи L,K , представляющие ДНК со следующей последовательностью:
цепь K [1] 5' - tgtactagttaactagtac - 3' [19]
||||||||||||||||||
цепь L [19] 3' - catgatcaattgatcatgt - 5' [1],
где
1 и 19 - номера первого и последнего нуклеотида.
- Функции белка, структура которого представлена в файле 1TRO.pdb
Данный белок - апорепрессор. В комплексе с L-триптофаном он связывается с промоторной областью триптофанового оперона и препятствует инициации транскрипции. Комплекс также регулирует синтез триптофанового репрессора, связываясь с его регуляторным сайтом. (по данным UniProt)
- Исследование структуры ДНК
Согласно данным find_pair и analyze, программ пакета x3dna, тип данной ДНК - B форма. Значения средних углов, формулы для подсчета находятся в прикрепленном отчете . В данном случае связывание с белком приводит к отклонению от линейной формы на величину порядка 20 градусов, однако искривление цепи может достигать и больших значений. Следствием подобного искривления является неравномерная плотность днк-белковых взаимдоействий. Пик приходится на "прямые" концы молекулы днк, центральная же часть инертна по отношению к белку.
- Исследование природы ДНК-белковых контактов
| Контакты атомов белка с |
Полярные |
Неполярные |
Всего |
| остатками 2'-дезоксирибозы |
2 |
21 |
23 |
| остатками фосфорной кислоты |
24 |
24 |
48 |
| остатками азотистых оснований со стороны большой бороздки |
3 |
15 |
18 |
| остатками азотистых оснований со стороны малой бороздки |
0 |
0 |
0 |
Данные для таблицы были получены при помощи скрипта
Резюме: Как и следовало ожидать, наибольшее число днк-белковых контактов связано с взаимодействием остатков фосфорной кислоты (т.к. находясь на периферии спирали, они наиболее доступны для различных взаимодействий). В меньшей степени это верно для остатков дезоксирибозы. Удивляет нечетность результатов для взаимодействий атомов большой бороздки, так как ,судя по изображению в RasMol, области связывания симметричны.
- Получение популярной схемы ДНК-белковых контактов с помощью nucplot
Результат расчетов программы nucplot в выходном файле конвертированном в формат pdf.
Ключевое отличие от результатов полученных средствами RasMol - отсутствие контактов белок-остатки дезоксирибозы. В остальном (учитывая различия методов поиска и отображения) результаты, на мой взгляд, идентичны.
с вашими результатами из п.III
- Распознающий днк-белковый контакт.
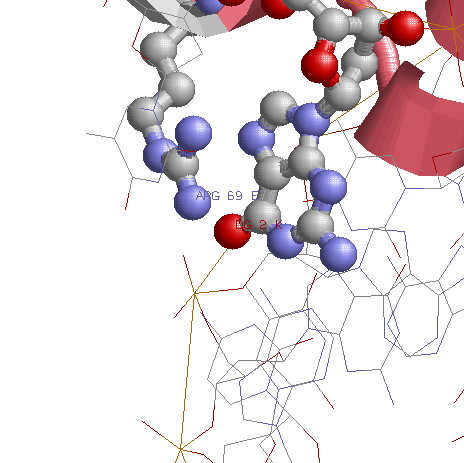 В расмотренном фрагменте структуры присутствуют, на мой взгляд, 2 распознающих днк-белковых контакта. Однако будет рассмотрен только один (ARG69:E и G2:K), в силу того, что из-за симметрии днк и белка-димер второй контакт совпадает с точностью до номеров остатка и нуклеотида.
Я считаю что этот контакт распознающий, так как это единственный полярный контак между основаниями большой и малых бороздок и атомами белка (что подтверждается схемой nucplot'a).
- Характеристика ДНК-связывающего домена Trp_repressor (PF01371)

Триптофановый репрессор (TrpR) связывается, по крайней мере, с 5 операторами в геноме ECOLI, подавляя генную экспрессию. Операторы с которыми он связывается варьируются в значительных пределах как по последовательностям нуклеотидов, так и по расположению в промоторе. В связанном с оператором состоянии, TrpR распознает последовательность 5'-ACTAGT-3' и препятствует инициации транскрипции. TrpR управляет trpEDCBA (trpO) опероном и генами продуцирующими trpR, aroH, mtr и aroL, которые вовлечены в синтез амино кислоты триптофан. Репрессор связывается с операторами только в присутствии L-триптофана, таким образом контролируя внутриклеточный уровень эффектора. Комплекс также регулирует синтез TrpR, связываясь с его собственным регуляторным сайтом. TrpR представляет собой димер, составленный из 6 идентичных спиральных субъединиц, 4 из которых формируют "ядро" белка и сплетание с 2 соответствующими спиралями другой субъединицы. (по данным Pfam)
|
|