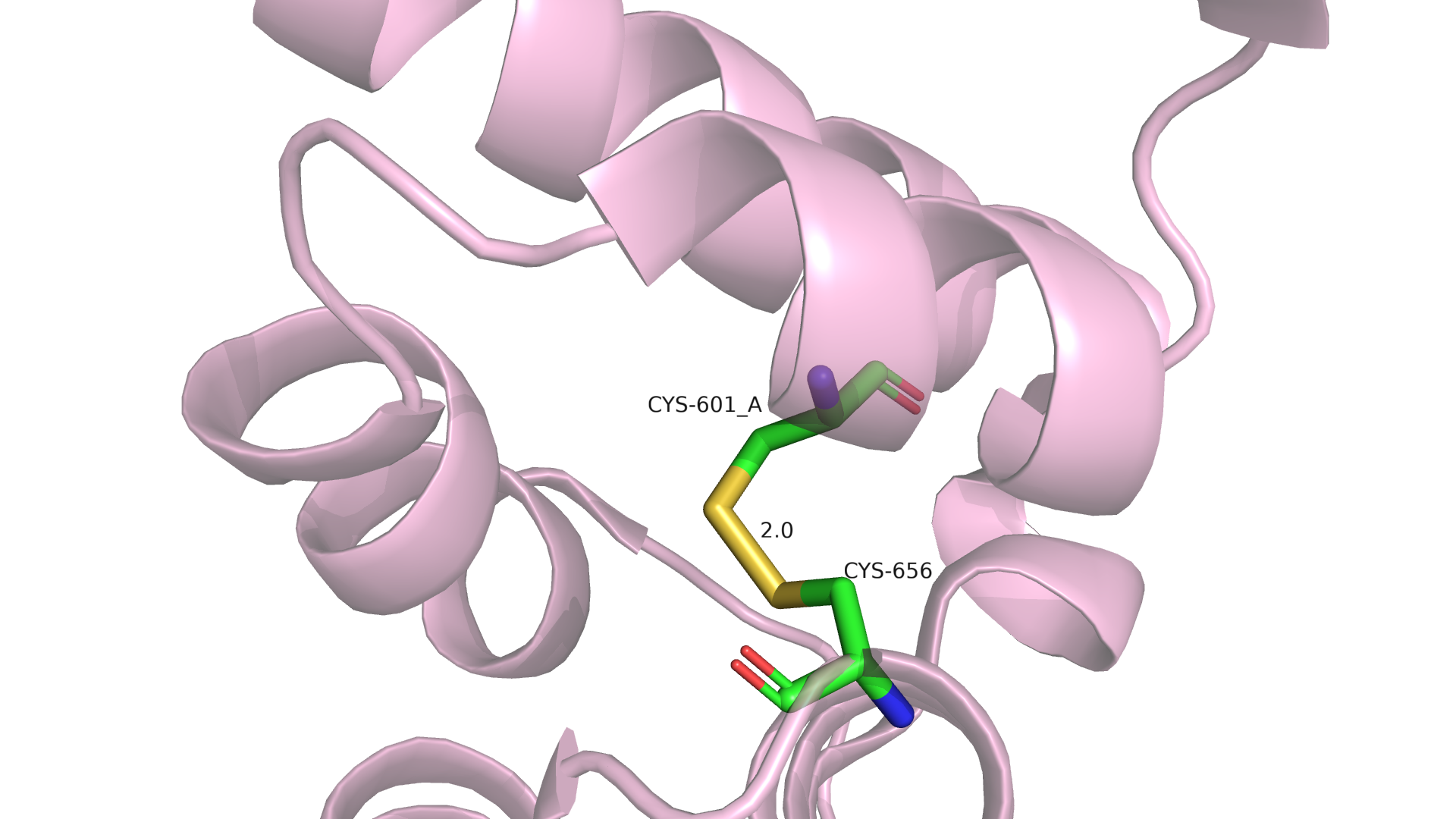
Рисунок 1.1 Первое альтернативное положение Cys601
PDBID:6AC5
В данном задании рассматриваются альтернативные положения Cys601 цепи A в структуре 6AC5. Прежде всего, для данного остатка существует 2
альтеративных положения. Для каждого из альт-локов населенность равна 0,5. Посмотрим, как они выглядят и какие связи их стабилизируют.

Рисунок 1.1 Первое альтернативное положение Cys601
В этом положении Cys601 образует дисульфидную связь с Cys656. Примечательно, что они расположены в соседствующих альфа-спиралях. Рассмотрим другой альт-лок.

Рисунок 1.2 Второе альтернативное положение Cys601
В этом положении Cys601 не образует дисульфидную связь с Cys656, разворачивается в другую сторону и, насколько я могу судить, других связей не образует. Попробуем предположить причину образования таких альернативных положений. Сначала оценим качество дисульфидной связи и электронного покрытия альт-локов.

Рисунок 1.3 Альтернативные положения Cys601, mesh электронной плотности на уровне подрезки 2.
Прежде всего посмотрим на дисульфидную связь. Длина связи 2 Å, угол 87.6 градусов, что довольно близко к предпочтительной длине 2.05 Å и углу в 90 градусов. Если смотреть на покрытие электронной плотность, то можно отметить лучшее покрытие альт-лока, образующего дисульфидную связь, что может косвенно свидетельствовать о предпочтительноти этого альт-лока. Поскольку населенность каждого из альтлоков равна 0,5, можно предположить, что в кристалле равное число белков с дисульфидной связью(между Cys601 и Cys656) и без нее. Я вижу две возможные причины для этой ситуации. Во-первых дисульфидная связь могла разрушиться во время получения структуры(из-за радиационного повреждения). Во-вторых образование и разрушение этой дисульфидной связи может участвовать в регуляции работы белка, особенно если учитывать, что эта связь соединяет две альфа-спирали и может вносить вклад в поддержание или изменение конформации белка.
PDBID:6AC5
В данном задании мы продолжаем работать со структурой 6AC5. Отобразим остов в виде sticks и покрасим спектром по B-фактору. B-фактор отображает подвижность частей белка. Красным цветом покрашены наиболее подвижные части белка, белым цветом покрашены части белка со средней подвижностью, синим же покрашены наименее подвижные части.
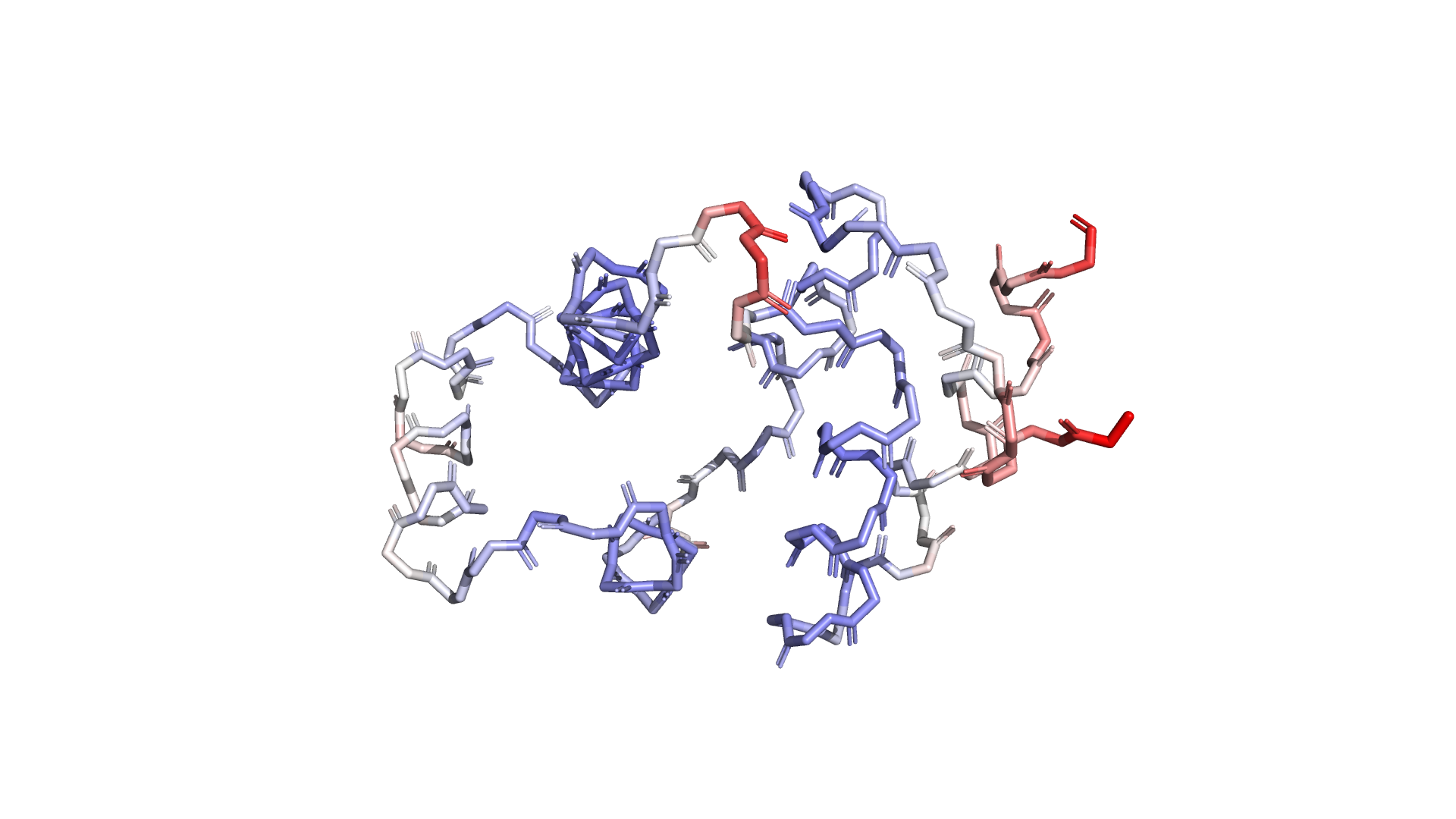
Рисунок 2.1 Остов 6AC5, окрашенный по b-фактору
Наиболее подвижными оказались части белка, расположенные на его концах, а также одна из частей, соединняющая две альфа-спирали. Наименее подвижными оказались сложенные в альфа-спирали части белка. В целом, части, расположенные на поверхности глобулы, окрашены в более теплые тона.
Теперь отдельно рассмотрим подвижный аминокислотный остаток Lys642. Покрасим его по b-фактору и построим вокруг него электронную плотность с уровнями подрезки 1 и 2.
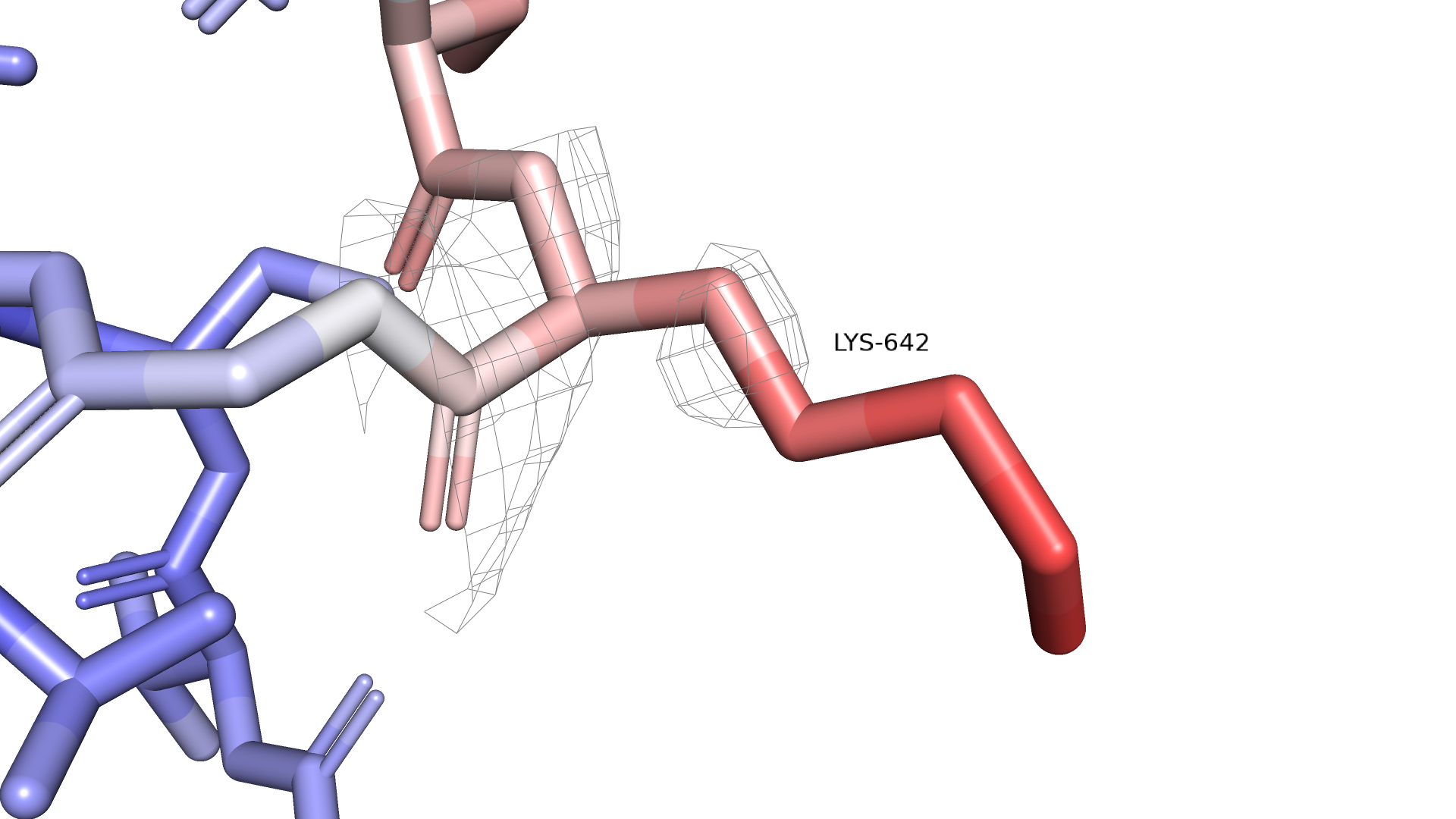
Рисунок 2.2.1 Lys642, окрашенный по b-фактору. Электронная плотность mesh, уровень подрезки = 1
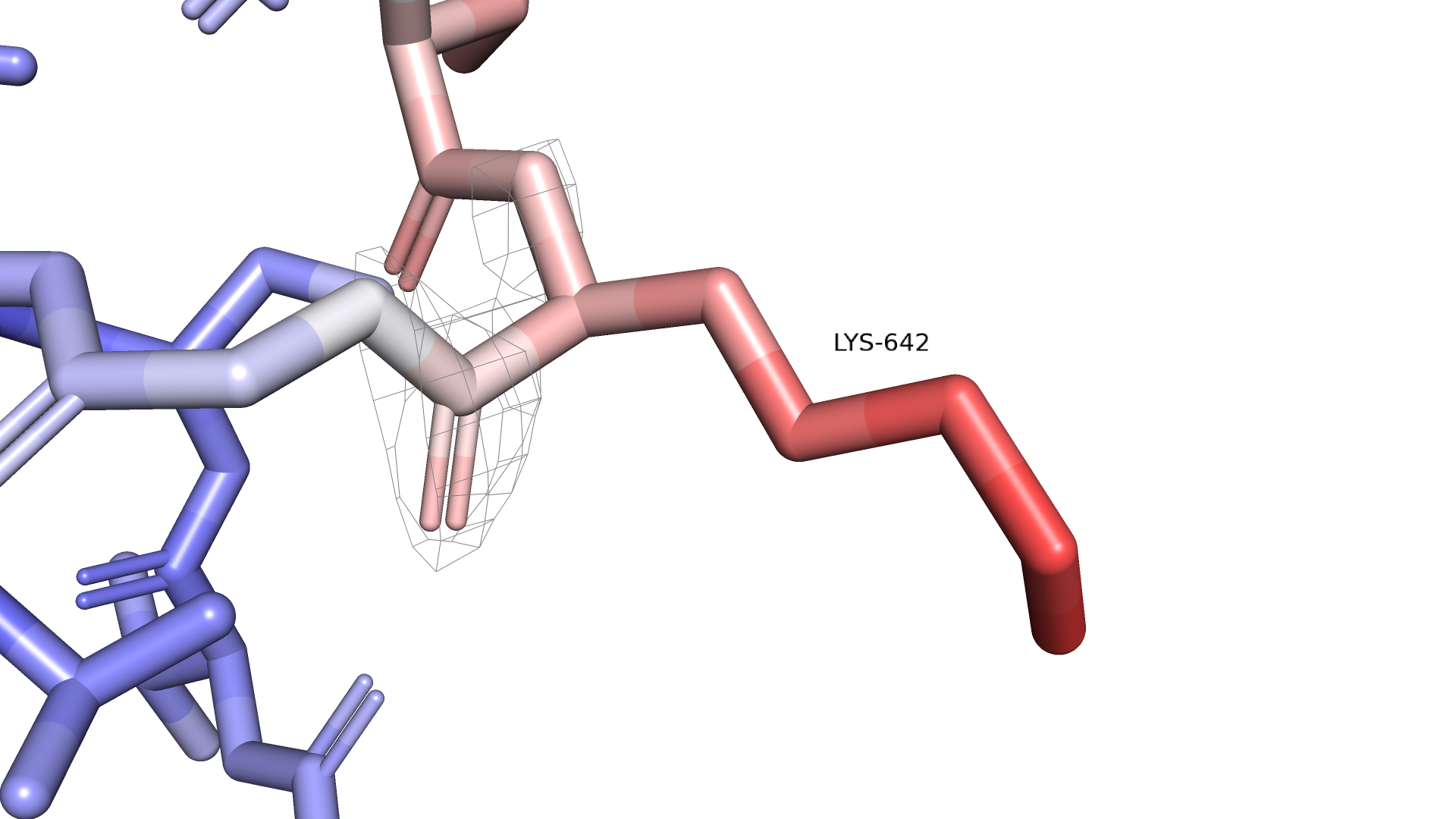
Рисунок 2.2.2 Lys642, окрашенный по b-фактору. Электронная плотность mesh, уровень подрезки = 2
Видно, что подвижный конец остатка не покрыт электронной плотностью даже на уровне подрезки 1, а на уровне подрезки 2 весь радикал перестает быть покрытым электронной плотностью. Таким образом, плохое покрытие свидетельствует о высокой подвижности, что мы и видим из b-фактора. Сравним Lys642 с Lys585, который, если судить по b-фактору, менее подвижный.
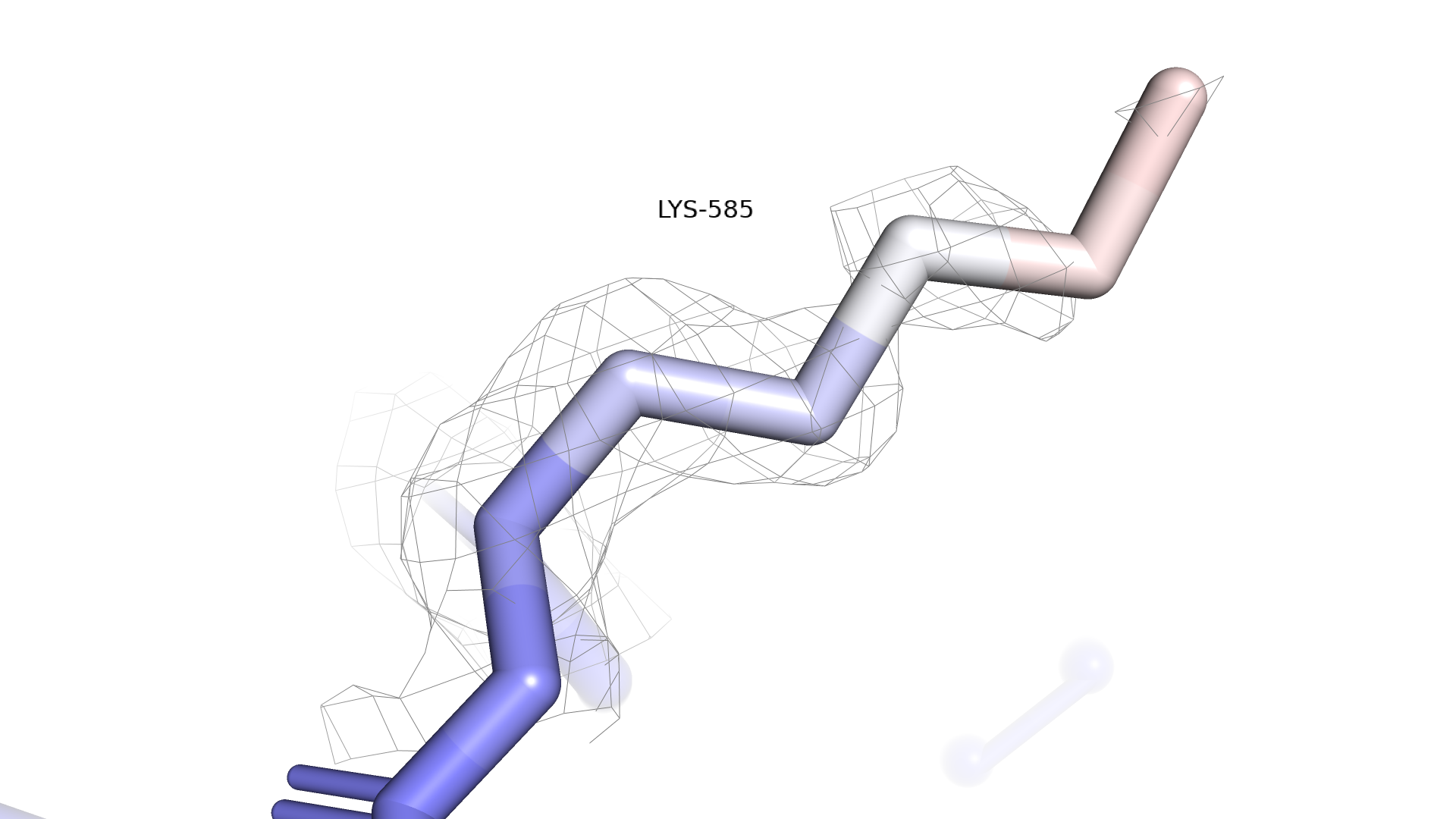
Рисунок 2.3.1 Lys585, окрашенный по b-фактору. Электронная плотность mesh, уровень подрезки = 1

Рисунок 2.3.2 Lys585, окрашенный по b-фактору. Электронная плотность mesh, уровень подрезки = 2

Рисунок 2.3.3 Lys585, окрашенный по b-фактору. Электронная плотность mesh, уровень подрезки = 3
Можно заметить, что на уроввне подрезки 1 Lys585 покрыт электронной плотностью практически полностью, а с увеличением уровня подрезки покрытие снижается постепенно. Полностью непокрытым радикал оказывается только на уровне подрезки 3. При этом покрытие пропадает с красных участков в первую очередь, а с синих участков в последнюю, что подтверждает предположение о связи b-фактора и электронной плотности.
PDBID:6AC5
В данном заднии восстанавливались соседи белка в кристалле.
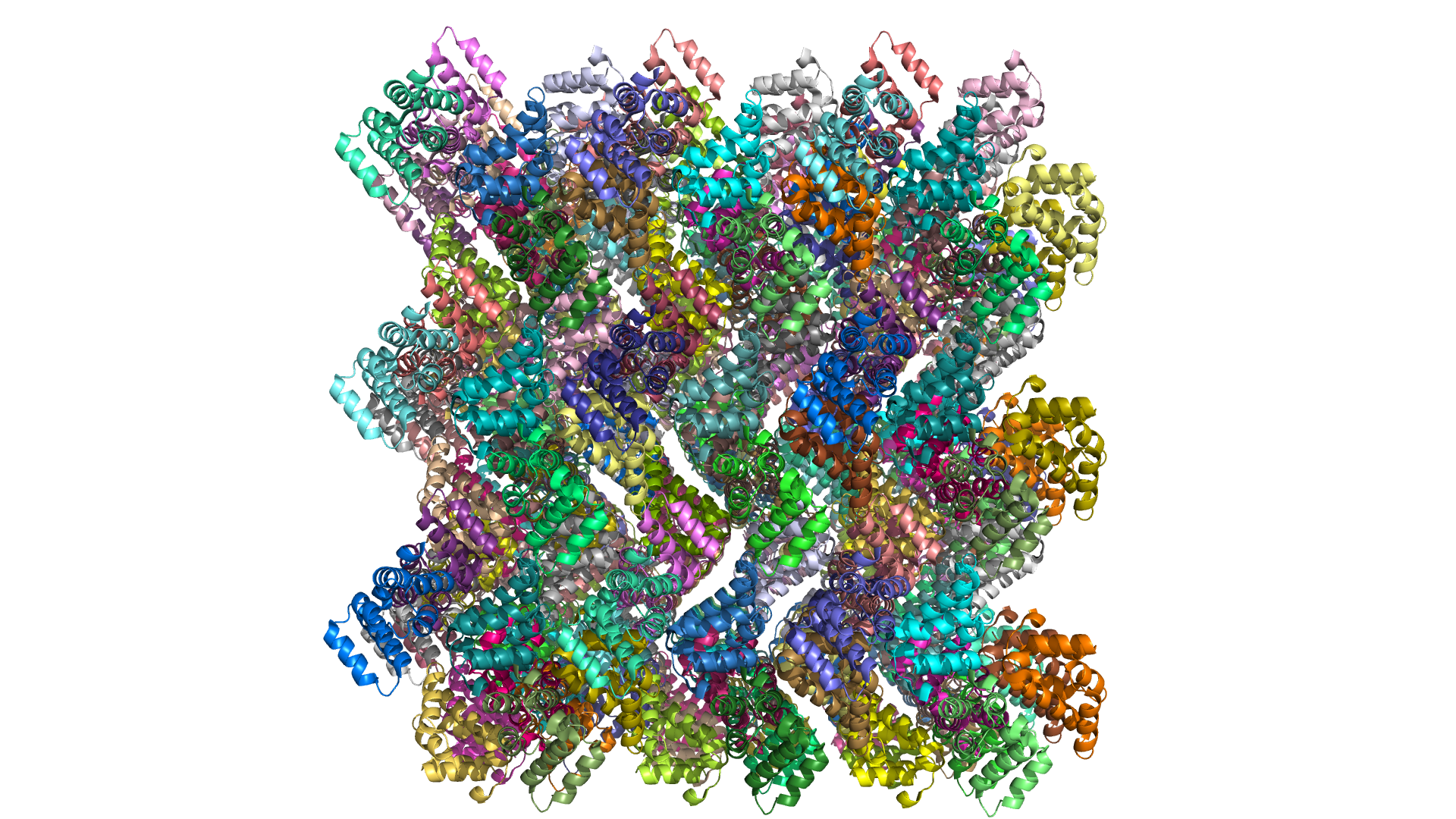
Рисунок 3.1 6AC5 с восстановленными соседями в кристалле
Соприкасаются с рассматриваемом белком 7 его соседей. Это становится ясно, если отобразить поверхности соседствующих структур.

Рисунок 3.2 6AC5 с соприкасающимися с ним соседями в кристалле
© Simon Konnov 2017-2020