Резюме
Данная работа представляет собой исследовательский мини-проект, направленный на изучение контактов биомолекул в составе комплексов, а также контактов биомолекул с лигандами. В качестве комплекса для изучения был выбран и рассмотрен трансмембранный белок ABCB10.
В ходе работы была получена информация о белок-белковых контактах, в частности ковалентных и водородных связях, солевых мостиках и гидрофобных контактах. Также была исследована плотность упаковки атомов в гидрофобном ядре. Помимо этого были рассмотрены лиганд-биомолекулярные и нк-белковые контакты и сделано предсказание трансмембранных участков.
1. Введение
Белок ABCB10 — переносчик митохондриальной АТФ-связывающей кассеты человека (ABC). Белок высоко экспрессируется в эритроидах — клетках, которые стремятся стать эритроцитами. ABCB10 встроен во внутреннюю мембрану митохондрий и, возможно, выкачивает свой субстрат из митохондриального матрикса в межмембранное пространство. Белок ABCB10 играет важную роль в организме у млекопитающих, он участвует в образовании гемоглобина и эритроцитов, защищает митохондрии от окислительного стресса. Ученые предложили несколько альтернативных функций для ABCB10, включая транспорт предшественников биосинтеза гема, стабилизацию транспортера железа SLC25A37 и транспорт пептидов. Дискуссия о роли ABCB10 продолжается, так как еще не нашлось биохимических подтверждений его функций.[1]
| PDB ID | 4AYT |
| PubMed | 23716676 |
| Uniprod ID | Q9NRK6 (ABCBA_HUMAN) |
Общая информация о лигандах структуры 4AYT
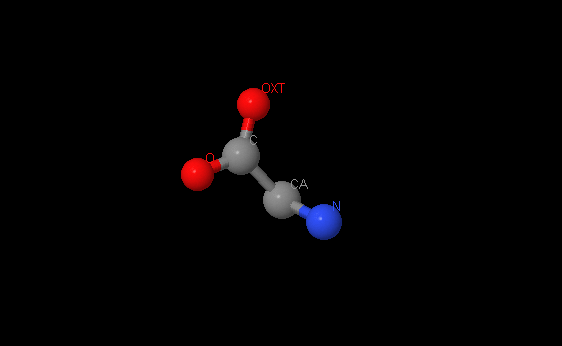
Название: Глицин
Брутто-формула: C2H5NO2
Название по UIPAC: 2-aminoethanoic acid
Молярная масса: 75.07 г/моль
DrugBank ID: DB00145
Порядковый номер: 1717
Аминокислота. Также является тормозящим нейромедиатором.
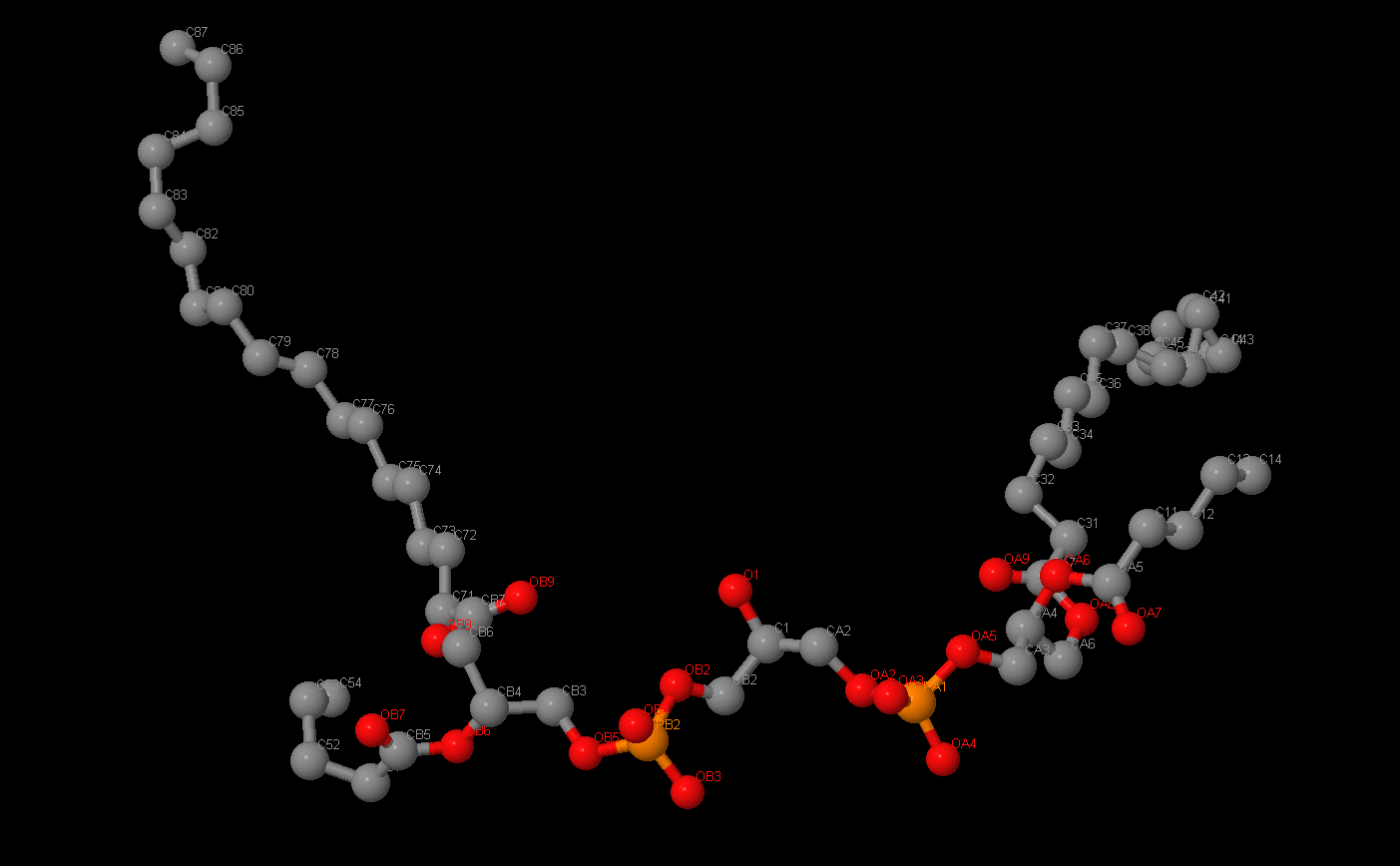
Название: Кардиолипин
Брутто-формула: C81H156O17P2
Название по UIPAC:[3-[[(2R)-2,3-di(octadecanoyloxy)propoxy]-oxido-phosphoryl]oxy-2-hydroxy-propyl] [(2R)-2,3-di(octadecanoyloxy)propyl] phosphate
Молярная масса: 1464.04 г/моль
DrugBank ID:DB03429
Порядковый номер: 1721
"Двойной" фосфолипид, так как вместо 2 остатков жирных кислот имеет 4. Важный компонент внутренней митохондриальной мембраны, где он составляет 20% всех липидов. Обычно находится в метаболически активных клетках сердцами скелетных мышц, в мембранах их митохондрий. Является изолятором и стабилизатором белковых комплексов, связанных с транспортом электронов. Он также "склеивает" эти комплексы.

Название: ион магния
Формула: Mg2+
Название по UIPAC: magnesium(+2)
Молярная масса: 24.30 г/моль
DrugBank ID: DB01378
Порядковый номер: 801
Необходимый участник синтеза белка на всех этапах этого процесса.
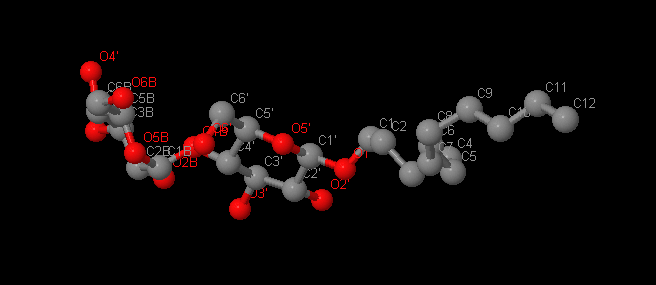
Название: Додецил-Бета-Д-Мальтоксид
Брутто-формула: С24H46O11
Название по UIPAC: (2R,3R,4S,5S,6R)-2-[(2R,3S,4R,5R,6R)-6-dodecoxy-4,5-dihydroxy-2-(hydroxymethyl)oxan-3-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol
Молярная масса: 510.62 г/моль
DrugBank ID: DB03279
Порядковый номер: 1720
Детергент для стабилизации и активации ферментов.
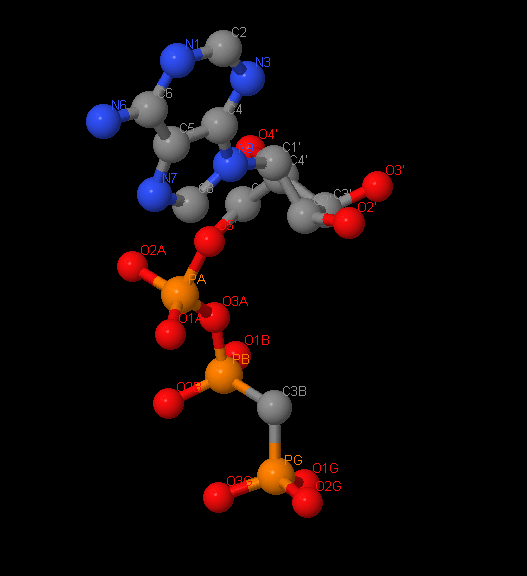
Название: Сложный эфир фосфометилфосфоновой кислоты и аденилатциклазы
Брутто-формула: C11H18N5O12P3
Название по UIPAC: [[[(2R,3S,4R,5R)-5-(6-aminopurin-9-yl)-3,4-dihydroxy-oxolan-2-yl]methoxy-hydroxy-phosphoryl]oxy-hydroxy-phosphoryl]methylphosphonic acid
Молярная масса: 75.07 г/моль
DrugBank ID: DB03909
Порядковый номер: 900
Аналог АТР(Аденозинтрифосфата), где атом кислорода, соединяющий бета и гамма фосфаты, заменен на атом азота. Это сильный конкурентный ингибитор растворимый и мембраносвязанной АТРазы, а также тормозит АТР-зависящие реакции окислительного фосфорилирования.
2. Материалы и методы
В данной работе применялись различные источники информации, такие как научный журнал PNAS, базы данных PDB, PubMed, Uniprot, инструмент TMHMM, метод предсказания положения белка в мембране. В качестве справочной литературы были использованы главы курса «Химические основы биологических процессов» и статья «Физические основы стекинг-взаимодействий нуклеиновых кислот в воде».
Для визуализации результатов были использованы такие инструменты, как JSmol и TMHMM. Для вычислений, помимо терминала в JSmol (где были посчитаны длины водородных связей и углы N-H-O), был использован калькулятор PIC для поиска стэкинг-взаимодействий.
3. Атлас контактов
3.1 Белок-белковые взаимодействия
3.1.1 Ковалентные связи
Дисульфидная связь — ковалентная связь между двумя атомами серы(S-S), входящими в состав цистеина. Дисульфидные мостики в белках образуются между тиольными группами (-SH) остатков цистеина в результате окислительного сворачивания. Угол между плоскостями, в которых лежат оба атома серы составляет примерно 90°. Другая серосодержащая аминокислота, метионин не может образовывать дисульфидные связи. В белке ABCB10 было найдено 3 молекулы цистеина, которые не образуют дисульфидные мостики, так как находятся на большом расстоянии друг от друга.
Команда "rectrict Cys" позволила нам убедиться в отсутствии данного типа связей.
Пептидная связь — связь, соединяющая аминокислоты в белке. Сопряжение связи C-N с карбонильной группой C=O делает пептидную связь на 10% короче, чем она должна быть. Связь приобретает характер двойной, возникают резонансные структуры. Так как вращение затруднено, возникает 2 изомера – цис- и транс-пептидная связь. Цис конформация энергетически невыгодна, поэтому почти все пептидные группы в белках находятся в транс конформации.[2] В белке ABCB10 были измерены пептидные связи, средняя длина которых составляет 1.35 Å.
Результаты измерений представлены в следующей таблице:
| # | Имена атомов | Длина связи (Å) | |
|---|---|---|---|
| Альфа-спирали | |||
| 1 | C(183VAL)-N(184ILE) | 1.36 | |
| 2 | C(185SER)-N(186MET) | 1.37 | |
| 3 | C(187SER)-N(188ALA) | 1.36 | |
| 4 | C(383HIS)-N(384VAL) | 1.35 | |
| 5 | C(381GLU)-N(382ALA) | 1.35 | |
| 6 | C(402THR)-N(403GLY) | 1.35 | |
| 7 | C(271LEU)-N(22IlE) | 1.35 | |
| 8 | C(377TYR)-N(378ALA) | 1.35 | |
| 9 | C(371MET)-N(372THR) | 1.35 | |
| 10 | C(654ILE)-N(655LEU) | 1.34 | |
| 310-спираль | |||
| 1 | C(622GLU)- N(623PHE) | 1.35 | |
| 2 | C(620PRO)-N(621GLN) | 1.36 | |
| 3 | C(621GLN)-N(622GLU) | 1.33 | |
| Бета-листы | |||
| 1 | C(551ILE)- N(552SER) | 1.35 | |
| 2 | C(552SER)- N(553LEU) | 1.34 | |
| 3 | C(553LEU)- N(554ASP) | 1.36 | |
| 4 | C(705ASP)- N(706GLN) | 1.34 | |
| 5 | C(711GLU)- N(712THR) | 1.34 | |
3.1.2 Водородные связи
Водородная связь — тип взаимодействия электростатической и частично ковалентной природы. Связь формируется при наличии атома электроатрицательного элемента и связанного с другим электроотрицательным элементом атома водорода, находящимися на достаточно близком расстоянии. Результатры измерений представлены в таблице:
| # | Имена атомов | Длина связи (Å) | Угол N-H-O (°) |
|---|---|---|---|
| Альфа-спирали | |||
| 1 | O(393 PHE) – N(397 GLY) | 3.13 | 149.5 |
| 2 | O(398 PHE) – N(402 THR) | 2.78 | 166.4 |
| 3 | O(406 GLY) – N(410 VAL) | 3.37 | 146.7 |
| - | Среднее значение | 3 | 155.97 |
| 310-спираль | |||
| 1 | O(662 GLY)- N(625 THR) | 3.4 | 103.7 |
| 2 | O(621 PRO)-N(624 ASN) | 3.12 | 127.7 |
| - | Среднее значение | 3.267 | 115.7 |
| Бета-слой | |||
| 1 | O(517 ILE) – N(492 LEU) | 2.91 | 163 |
| 2 | O(703 VAL) – N(710 THR) | 2.86 | 165.7 |
| 3 | O(495 LYS) – N(550 THR) | 3.02 | |
| - | Среднее значение | 3.57 | 158.53 |
Как видно из таблицы, водородные связи в бета-слое по расстоянию между донорной карбонильной и акцепторной иминогруппой являются слабыми, в то время как у играющих основную роль в поддержании структуры альфа-спиралей водородные связи достаточо сильные[5]
Посмотреть визуализацию водородных связей в структуре, а также посмотреть скрипт можно в отдельном разделе.
Интересный случай, когда формирование водородных связей (выделены циановым), в альфа-спирали (534-541 остатки) не соотвествует стандратному паттерну представлен на Изображении 1. Формирование подобных водородных связей может быть обусловлено повышенной кислотностью митохондриального матрикса (обоснование положения изложено в пункте 4).
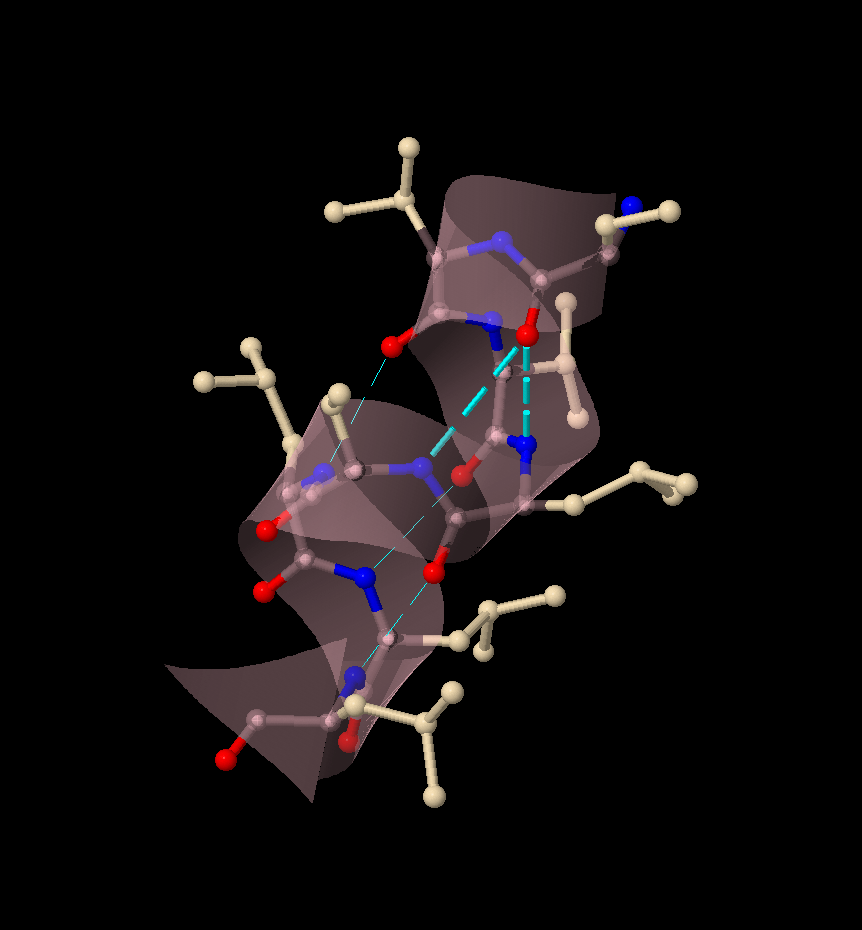
3.1.3 Солевые мостики
Иогенные группы (остатки глутаминовой, аспарагиновой кислот; гистидина, лизина и аргинина) участвуют в ионных взаимодействиях, образуя так называемые солевые мостики. Во взаимодействиях участвуют отрицательно заряженные карбоксильные группы радикалов "Asp" и "Glu" кислот и положительно заряженные группы радикалов "Lys","Arg" или "His" кислот. Эти взаимодействия возможны как внутри белка, так и с другими молекулами.
Для поиска солевых мостиков есть несколько подходов. Можно искать их вручную, для этого необходимо выделить полярные остатки аминокислот и раскрасить их в соответствии с зарядом. А далее визуально искать те аминокислотные остатки, что скорее всего образуют ионную связь. Можно приметь другой подход и воспользоваться калькулятором белковых взаимодействий, в частности ионных.
Мы в работе применяли оба подхода, но для верности решили остановится на втором, для чего использовали PIC: Protein Interactions Calculator. Согласно машинным манипуляциям, всего в белке насчитывается 25 солевых мостиков.
Два из них были рассмотрены более подробно: один между [GLU]356 и [ARG]357, второй между [LYS]650 и [ASP]593, результат представлен на Изображении 2 и Изображении 3 соответственно.
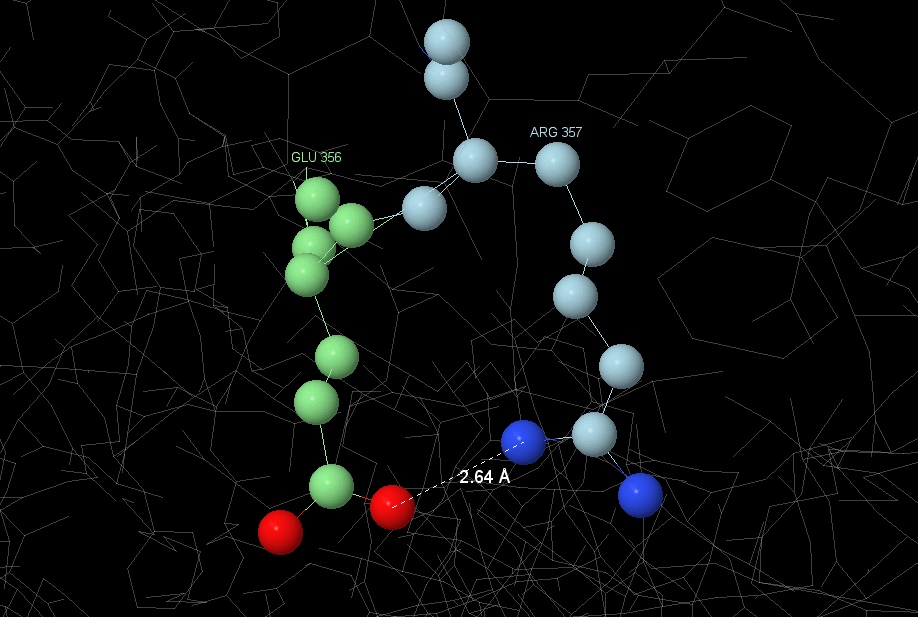
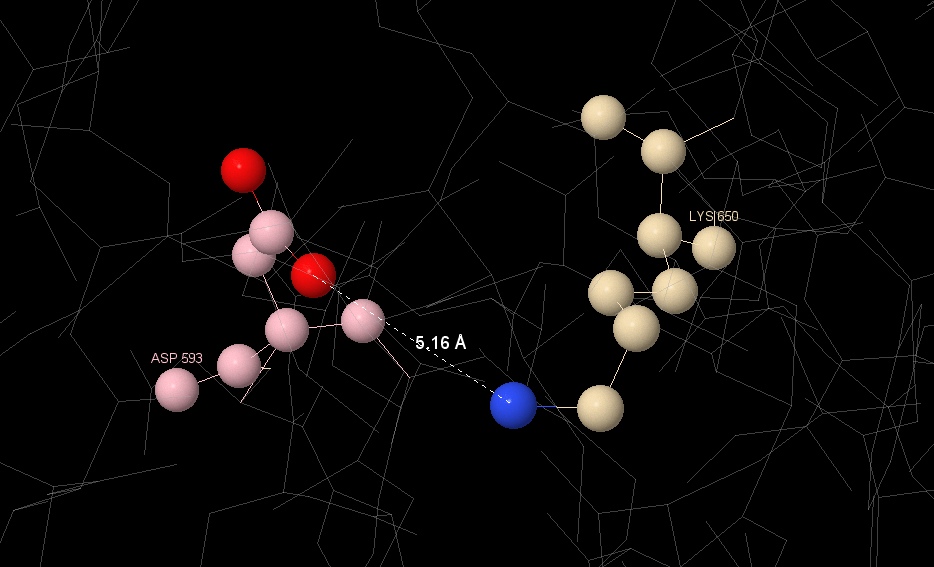
3.1.4 Гидрофобные взаимодействия
В качестве гидрофобного остатка для исследования плотности упаковки в гидрофобном ядре был выбран [PHE]398:A. В сценарии гидрофобный остаток был определен как myresidue. На расстоянии 1 Å от остатка не наблюдается атомов окружения. Первые атомы окружения появляются на расстоянии 2 Å. На расстоянии 4 Å видно, что остаток полностью покрыт атомами окружения.
Приблизительное расстояние между несвязанными ковалентно атомами окружения 3.35 Å, что меньше диаметра воды 4,916 Å. Следовательно, между соседними атомами не может поместиться еще одна молекула.
Стекинг-взаимодействия
Стекинг-взаимодействия - это нековалентные взаимодействия между органическими соединениями, содержащими ароматические системы. Наиболее широко они распространены в ДНК, где они повышают стабильность молекулярной структуры, однако в белках также встречаются.
В белках этот эффект могут давать ароматические аминокислоты - Phe, Tyr, Trp. Так называемый T-стекинг характеризуется следующей картиной: атомы водорода с частичным положительным зарядом одной ароматической системы направлены к центру другой ароматической системы перпендикулярно плоскости последней[3].
Поиск стэкинг-взаимодействия в белке осуществлялся с помощью Protein Interactions Calculator[4]. Output калькулятора:
| # | Position | Residue | Position | Residue | Dihedral Angle |
|---|---|---|---|---|---|
| 1 | 262 | PHE | 263 | PHE | 78,72 |
| 2 | 332 | TYR | 398 | PHE | 75,4 |
| 3 | 488 | PHE | 565 | TRP | 103,49 |
| 4 | 501 | TYR | 544 | TYR | 87,13 |
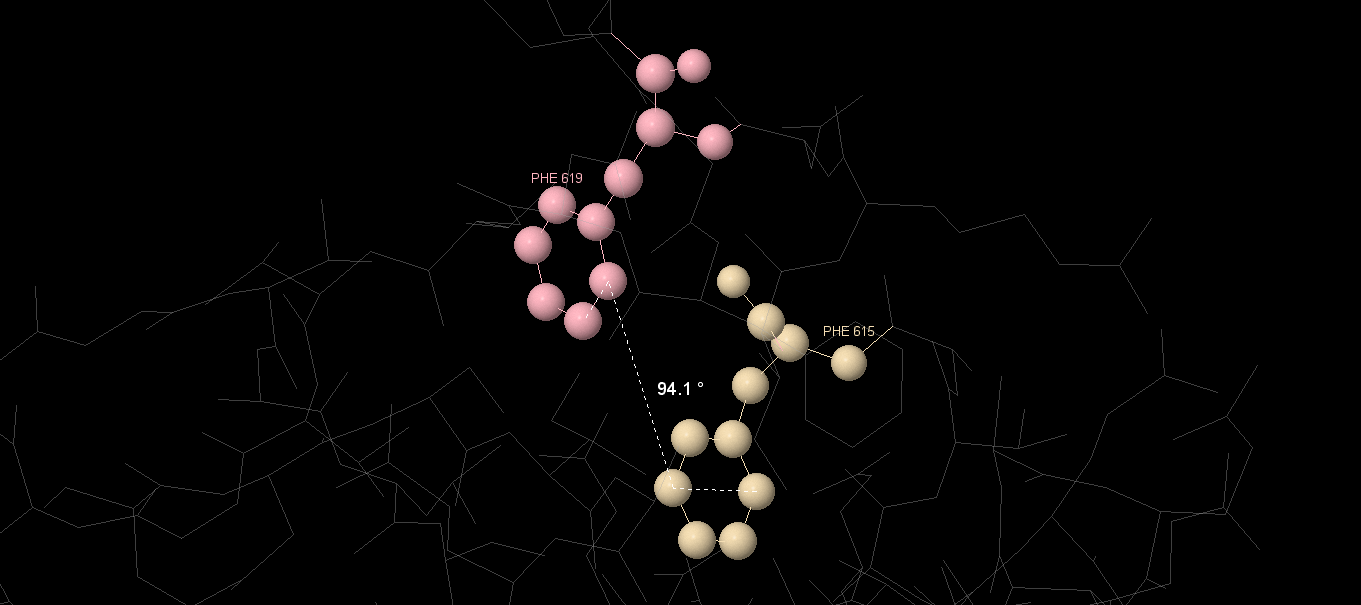
| 5 | 615 | PHE | 619 | PHE | 96,33 |
Графические изображения некоторых из найденных взаимодействий представлены на рисунках. Из анализа величины углов между аминокислотными остатками можно предположить, что это T-стэкинг (угол ≈90°).
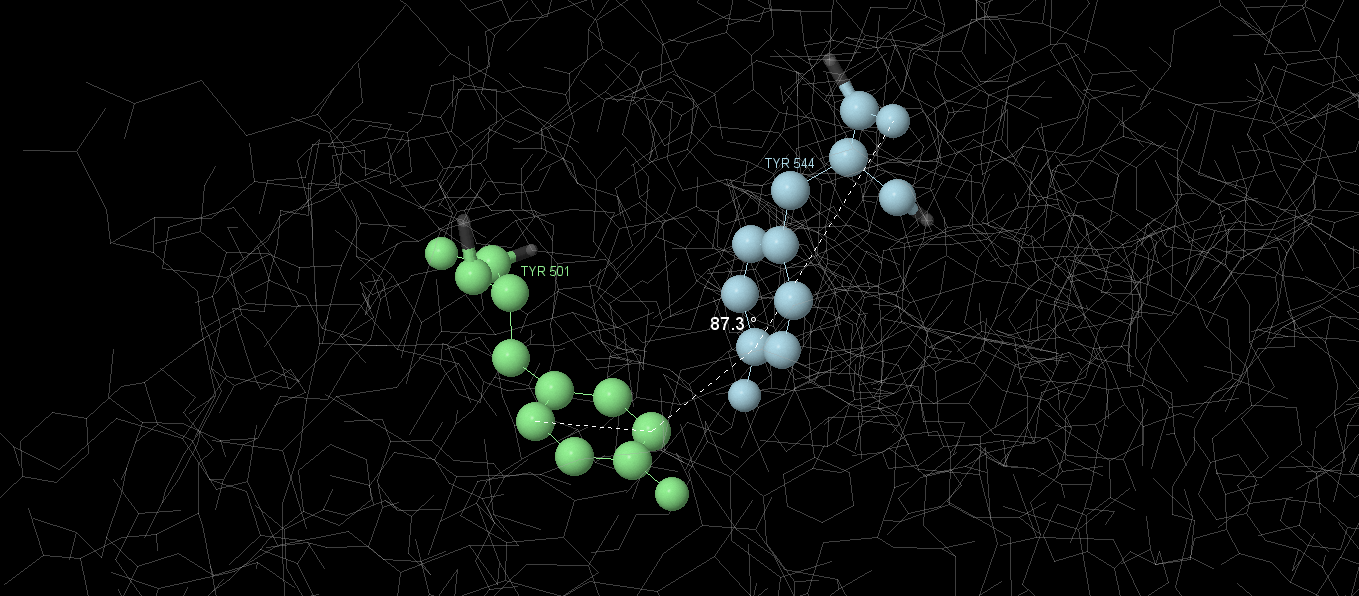
3.2 Лиганд-биомолекулярные контакты
3.2.1 Mg

Магний координационно пришит к ACP900 (аналог ATP), а также к Ser799 и Gln802 через кислород (с остатками аминокислот он может быть связан или через кислород или через электростатические взаимодействия).
3.2.2 LMT

Возможно образование стэкинг-взаимодействий через TYR200 (расстояние между ароматическими элементами предсказывает высокую вероятность образования такого типа контакта). Также, расстояние <4Å между LYS1710 и ASP1714 предполагает наличие солевых мостиков. Водородные связи возможны, но большое расстояние ставит их существование под вопрос.

3.2.3 Gly

Возможно образование стэкинг-взаимодействий через TYR200(расстояние между ароматическими элементами предсказывает высокую вероятность образования такого типа контакта). Также, расстояние <4Å между LYS1710 и ASP1714 предполагает наличие солевых мостиков. Водородные связи возможны, но большое расстояние ставит их существование под вопрос.
3.2.4 CDL

Основной контакт с белком – через водородные связи(расстояние меньше 3Å).
3.2.5 ACP

Кроме уже описанных координационных связей с Mg1717, высока вероятность образования стэкинг-взаимодействий с TYR501, PRO502, TYR544(длина связи<12Å), а также водородных связей(длина связей в районе 3Å).
4. Положение в мембране
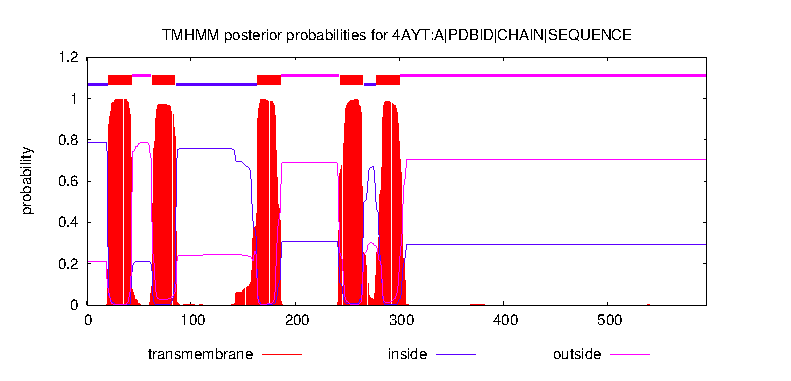
Ресурс TMHMM позволил определить наиболее вероятное расположение частей белка относительно мембраны. Одна субъединица, предположительно, имеет пять трансмембранных участков, представленных альфа-спиралями. Вероятностное распределение представленно на Графике 1, предполагаемое расположение частей по аминокислотным остаткам можно изучить в таблице:
| В митохондриальном матриксе | 1-20 | 86-163 | 266-277 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Трансмембранный участок | 21-43 | 63-85 | 164-186 | 243-265 | 278-300 | ||||||
| Межмембранное прастранство | 44-62 | 187-242 | 301-595 |
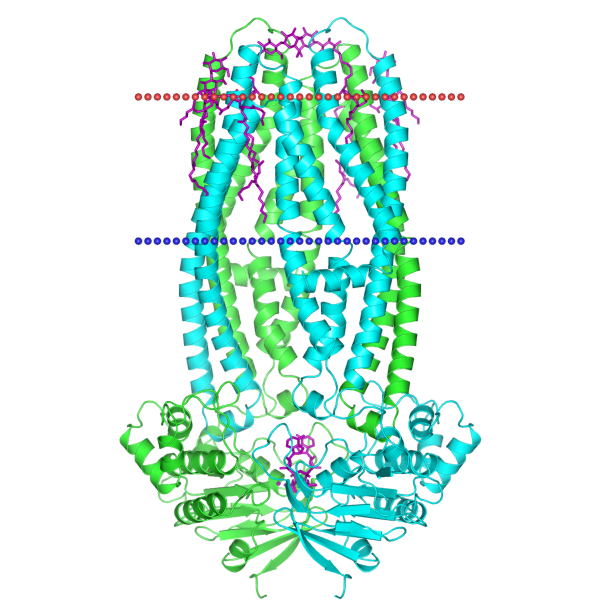
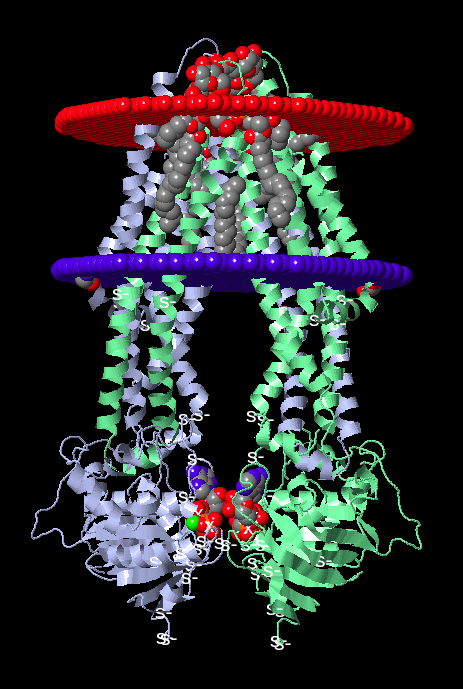
Ниже на Изображении 6 и 7 представлена визуализация расположения полной структуры в мембране с использованием JSmol и OPM соответственно.
5. Личный вклад
Болтышева А.И. изучила все вопросы, связанные с лигандами: провела обзор лигандов, исследование и измерение лиганд-белковых взаимодействий, а также подготовила скрипт для репрезентации соответствующих типов взаимодействий.
Вашуркина С.А. служила связующим звеном между относительно независимо работающими членами группы, а также проанализировала характеристики солевых мостиков и составила скрипт, выводящий. Помимо этого она внесла значительный вклад в исследование водородных и гидрофобных взаимодействий, к последнему относится рассмотрение стекинг-взаимодействий. Также её вклад дополняется написанием резюме.
Вклад Камкиной Т.Д. заключается в написании введения и рассмотрения гидрофобных взаимодействий. Она провела анализ литературы и изучила гидрофобное ядро в белке. Её работа заключает в себе ещё и описание характеристик пептидных связей и дисульфидных мостиков, а также подготовку скриптов к соответствующим апплетам.
Скворцов Д.П. занимался дизайном сайта, компиляцией результатов от остальных членов исследовательской группы, а также рассмотрением водородных связей вместе с Вашуркиной С.А. Им была проведена адаптация графической, текстовой информации и скриптов для сайта. Он занимался редактированием, координациией и консультацией. Им проведено нахождение вероятности расположения белковых структур в мембране, а так же приведена визуалищация белка в митохондриальной мембране.
6. Благодарности
Выражаем свою благодарность преподавателям практической биоинформатики Факультета биоинженерии и биоинформатики Московского государственного унивеститета им. Ломоносова за предоставленную возможность проявить свои способности, а так же наставничество и помощь в разрешении возникающих вопросов.
7. Список литературы
-
Structures of ABCB10, a human ATP-binding cassette transporter in apo- and nucleotide-bound states Chitra A. Shintre, Ashley C. W. Pike, Qiuhong Li, Jung-In Kim, Alastair J. Barr, Solenne Goubin, Leela Shrestha, Jing Yang, Georgina Berridge, Jonathan Ross, Phillip J. Stansfeld, Mark S. P. Sansom, Aled M. Edwards, Chas Bountra, Brian D. Marsden, Frank von Delft, Alex N. Bullock, Opher Gileadi, Nicola A. Burgess-Brown, and Elisabeth P. Carpenter
PNAS June 11, 2013 110 (24) 9710-9715;
https://doi.org/10.1073/pnas.1217042110
Edited* by Wayne A Hendrickson, Columbia University, New York, NY, and approved April 24, 2013 (received for review October 2, 2012)
-
Курс Химические основы биологических процессов А.В. Бачевой и М.Э. Зверевой для факультета биоинженерии и биоинформатики, МГУ, 2019
-
R Luo, H S Gilson, M J Potter, and M K Gilson “The physical basis of nucleic acid base stacking in water.” Biophys J. 2001 Jan; 80(1): 140–148.
doi: 10.1016/S0006-3495(01)76001-8
PMCID: PMC1301220
PMID: 11159389
- P I C : Protein Interactions Calculator, Molecular Biophysics Unit, Indian Institue of Science, Bangalore.
Апплет и скрипты