| « Пространственные структуры белков. Визуализатор Jmol | Внутримолекулярные взаимодействия боковых цепей » |
Остовные водородные связи в α-спиралях и β-листах
α-спирали и β-листы — наиболее известные типы вторичной структуры белков. В α-спирали остов образует плотные витки вокруг длинной оси молекулы, в β-спирали — зигзагообразную структуру. Зигзагообразные цепи, которые называют β-слоями, могут быть уложены параллельно и образовать ряд складок [1].
В формировании и поддержании этих структур участвуют водородные связи.
α-спирали
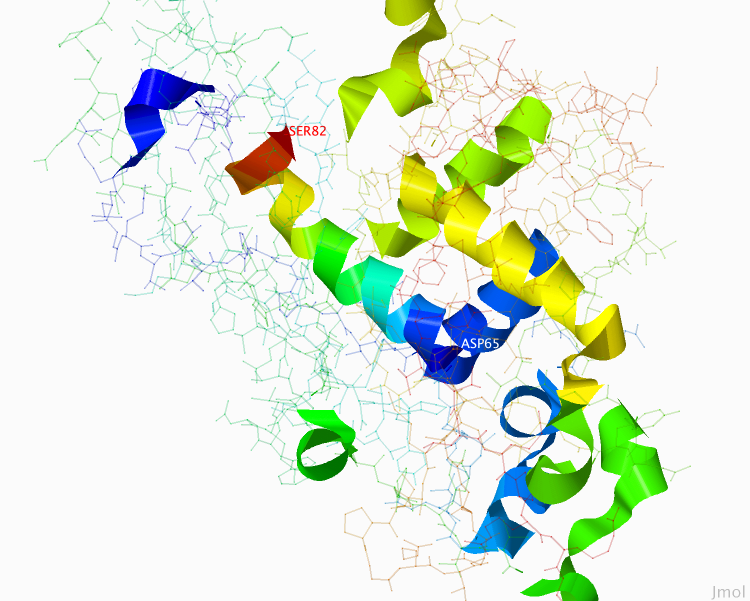
Рисунок 1. Пространственное расположение α-спиралей в цепочке B. SER82 и ASP65 обозначают последнюю и первую аминокислоту рассматриваемой далее α-спирали.
Рисунок получен с помощью программы J-mol.
Рассмотрим водородные связи в одной из α-спиралей белка дегидратазы (общее изображение спиралей данного белка представлено на Рисунке 1). Водородная связь образуется между атомом водорода, который связан с электроотрицательным атомом, и другим электроотрицательным атомом. Рассмотрим данную связь на конкретном примере. На участке данной спирали, который изображён на Рисунке 2, донором водорода является атом азота аминокислотного остатка (номер 74) фенилаланина; акцептор — атом кислорода тоже фенилаланина, но только под номером 70. Длина связи — 2.8 Å. Разница между номерами остатков равна четырём, следовательно в водородной связи участвует атом каждого четвёртого аминокислотного остатка.
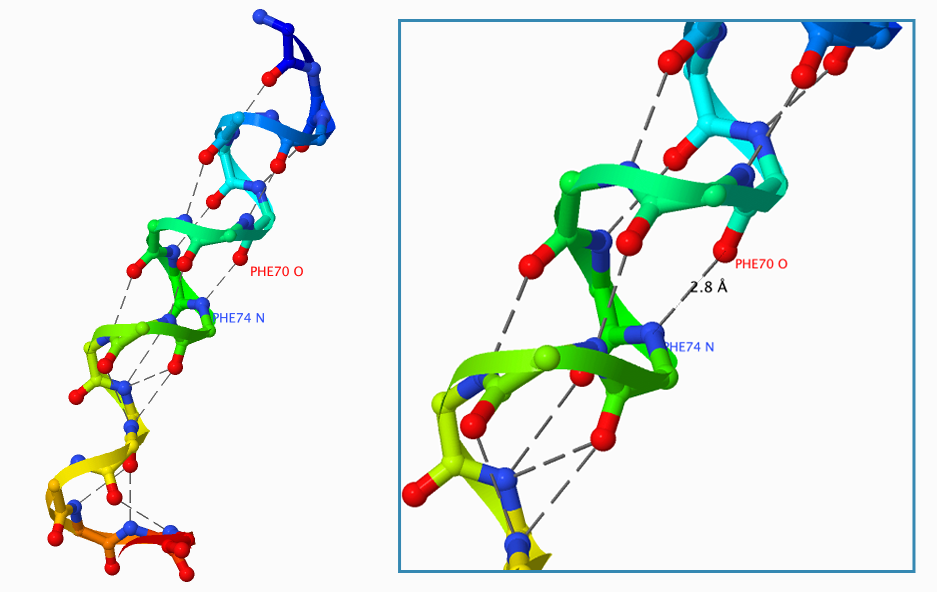
Рисунок 2. Водородные связи в α-спирали цепочки В, соответствующая 65-82 аминокислотным остаткам.
Красным цветом обозначены атомы кислорода, синим — атомы азота, серым (пунктирными линиями) — водородные связи.
Рисунок получен с помощью программы J-mol.
Шаг α-спирали и число остатков на виток.
Данная α-спираль состоит из 18 аминокислотных остатков и содержит примерно 5 витков. Значит, на один виток спирали приходится 3,6 аминокислотных остатков.
Расстояние, параллельное оси спирали, показано на Рисунке 3 и равно 24,98 Å. Тогда шаг спирали равен примерно 5 Å.
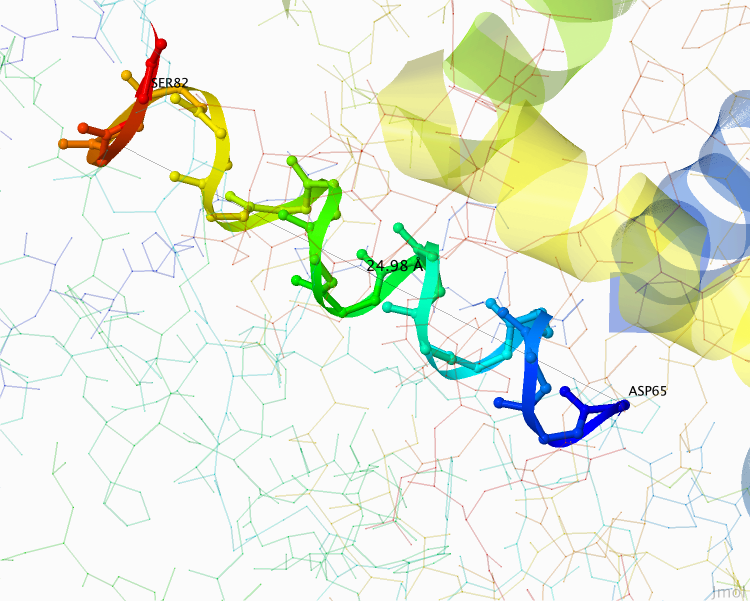
Рисунок 3. Одна из α-спиралей в цепочке B. SER82 и ASP65 обозначают последнюю и первую аминокислоту рассматриваемой далее α-спирали. Чёрной линией обозначено расстояние, параллельное оси спирали.
Рисунок получен с помощью программы J-mol.
β-листы
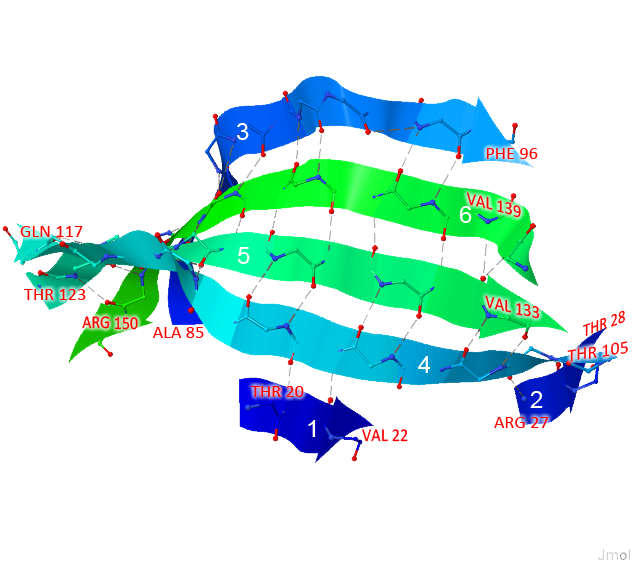
Рисунок 4. β-лист цепочки А в пространстве. THR 20 и ARG 150 — начало и конец β-листа соответственно, цифрами обозначены тяжи, составляющие этот лист, серым цветом (пунктирными линиями) — водородные связи.
Рисунок получен с помощью программы J-mol.
Рассмотрим β-лист цепочки А, соответствующий 20-150 аминокислотным остаткам. Из Рисунка 4 видно, что он состоит из шести β-цепей, которые расположены антипараллельно. Атомы, образующие водородные связи, находятся друг напротив друга, поэтому сами связи параллельны друг другу.
На Рисунке 5 водородные связи изображены более детально. Донор и акцептор здесь такие же, как и в α-спирали.
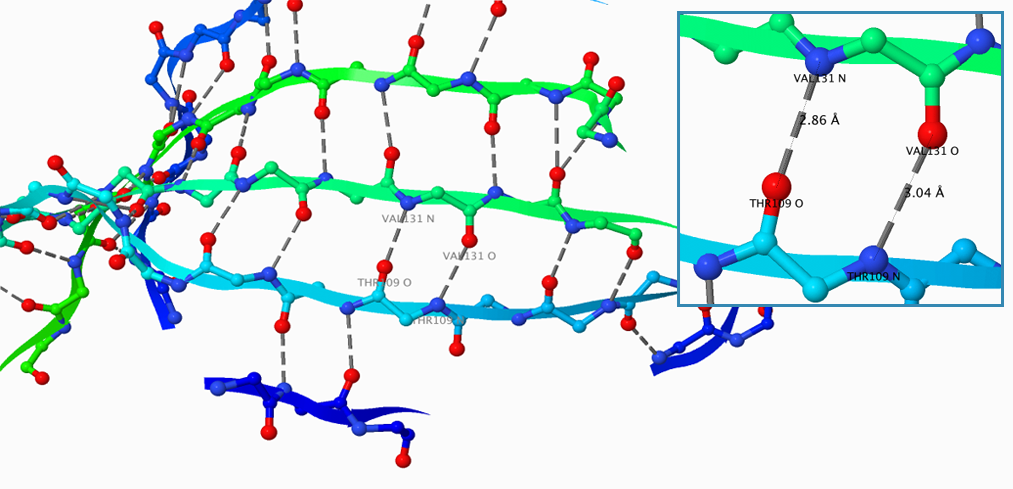
Рисунок 5. Водородные связи в β-листе. Красным цветом обозначены атомы кислорода, синим — азота, серым цветом (пунктирными линиями) — водородные связи.
Рисунок получен с помощью программы J-mol.
[1] Основы биохимии Ленинджера. Том 1. Основы биохимии строения и катализ
ISBN 978-5-94774-365-4, 978-5-94774-364-7; 2011 г.