| « Остовные водородные связи в α-спиралях и β-листах | Гидрофобные взаимодействия » |
Внутримолекулярные взаимодействия боковых цепей
Помимо взаимодействий между молекулами основной цепи (водородные связи в α-спиралях и β-листах) в формировании и поддержании пространственной структуры белка участвуют внутримолекулярные взаимодействия боковых цепей.
Солевые мостики
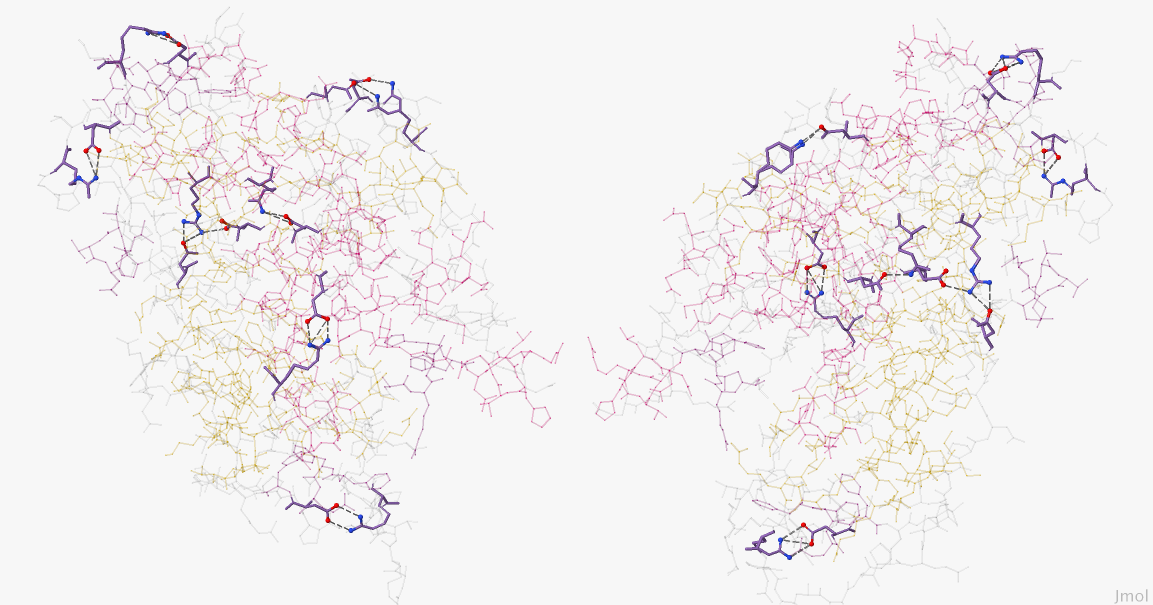
Рисунок 1. Солевые мостики в пространстве. Красным цветом обозначен отрицательно заряженный атом (кислород), синим — положительно (азот), фиолетовым — углеродный скелет молекулы.
Изображение получено с помощью программы J-mol.
Солевой мостик —внутримолекулярное взаимодействие, возникающее между отрицательно и положительно заряженными атомами в боковых цепях белка.
Для поиска солевых мостиков в белке я сначала использовала данный скрипт, а потом скрипт, написанный собственноручно (его можно скачать здесь). На Рисунке 1 представлен результат использованных скриптов. Ниже будет приведено некоторое объяснение команд из этого скрипта.
Скрипт для поиска солевых мостиков.
Основные строчки, которые как раз и ищут возможные солевые мостики:
select (within(GROUP,within(3.5, (arg*.nh? or lys*.nh?)) and (asp*.od? or glu*.od?))
or within(GROUP,within(3.5, (asp*.od? or glu*.od?)) and (arg*.nh? or lys*.nh?)))
select selected and ((within(3.5, hbnegative) and hbpositive) or
(within(3.5, hbpositive) and hbnegative)); cpk 70; color cpk
Первая строчка выделяет целиком остатки с атомами, которые теоретически могут быть заряжены положительно (arg*.nh?, lys*.nh?) или отрицательно (asp*.od?, glu*.od?). При этом расстояние между ними не должно превышать 3,5 Å (это указывается первым параметром в операторе within).
Второй строчкой выделяются конкретные атомы, которые участвуют в солевом мостике. Для этого мы пересекаем (оператор AND) полученное множество атомов (selected) с группой атомов, полученной после использования первого скрипта (hbpositive — группа положительно заряженных атомов, hbnegative — группа отрицательно заряженных атомов. Эти две группы — результат работы первого скрипта).
connect 3.5 (*.nh?) (*.od?) hbonds
Строчкой, расположенной выше, мы создаём водородные связи между атомами, полученными из предыдущей операции (положительно и отрицательно заряженным соответственно, расстояние между которыми не превосходит 3.5 Å).
Данная строка не всегда корректно работает, соединяя сразу несколько атомов с одним, поэтому лучше всего проделывать эту операцию вручную, сначала выбирая два нужных атома (select первый атом, второй атом), а потом соединяя их водородной связью (connect hbond). Но зато она даёт скрипту некую универсальность*.
Солевые мостики между аргинином 152 и аспарагиновой кислотой 14.
Рассмотрим солевые мостики между остатком аргинина и аспарагиновой кислоты. В первой и второй связи атом азота является донором водорода, а кислород — его акцептором. Длина связи в первом случае равна 3,01 Å, во втором — 3,03 Å.
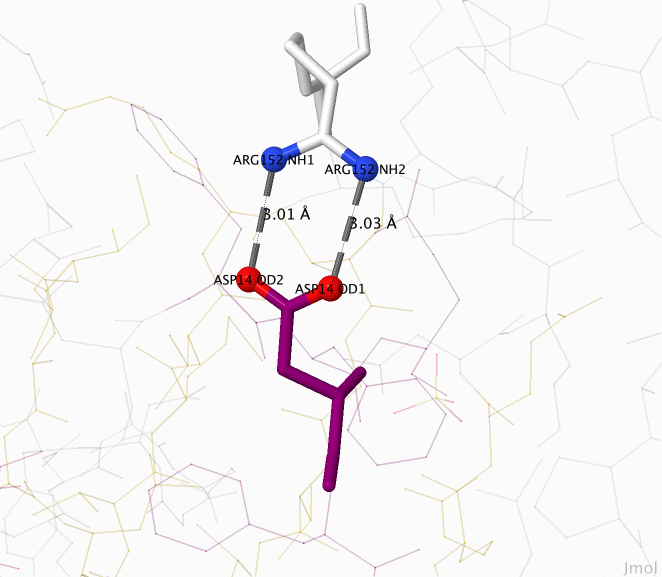
Рисунок 2. Солевые мостики между аминокислотными остатками аргинина 152 и аспарагиновой кислоты 14.
Красным цветом обозначены атомы кислорода, синим — атомы азота, серым (пунктирными линиями) — солевые мостики.
Рисунок получен с помощью программы J-mol.
* — По идее, скрипт должен быть универсальным и находить солевые мостики и в других белках, но проверить это у меня пока не было возможности.
Водородная связь, не являющаяся солевым мостиком
На Рисунке 3 показана водородная связь между остатком аспарагиновой кислоты и аргинином. Она не является солевым мостиком, так как в образовании связи участвует атом кислорода из основной цепи. Длина связи — 3,19Å.
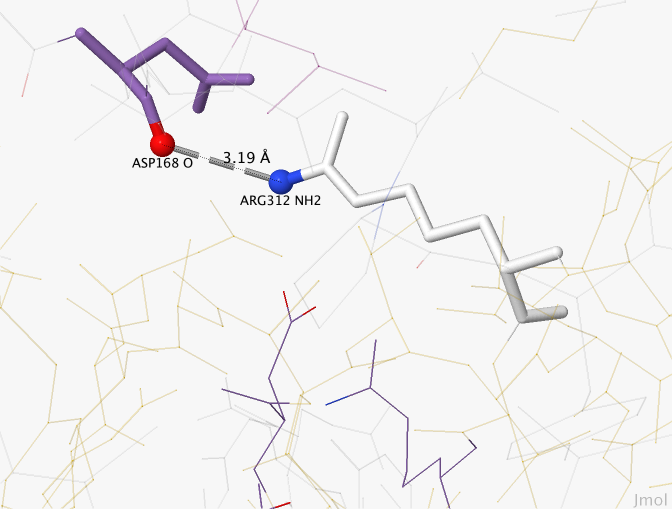
Рисунок 3. Водородная связь, не являющаяся солевым мостиком на примере связи между остатками аспарагиновой кислоты 168 и аргинина 312. Красным цветом обозначен атом кислорода, синим — азота, серой пунктирной линией — водородная связь.
Рисунок получен с помощью программы J-mol.
Дисульфидный мостик
Дисульфидный мостик возникает благодаря образованию дисульфидной (ковалентной) связи между двумя остатками цистеина. Дисульфидные мостики также участвуют в стабилизации пространственной структуры белка.
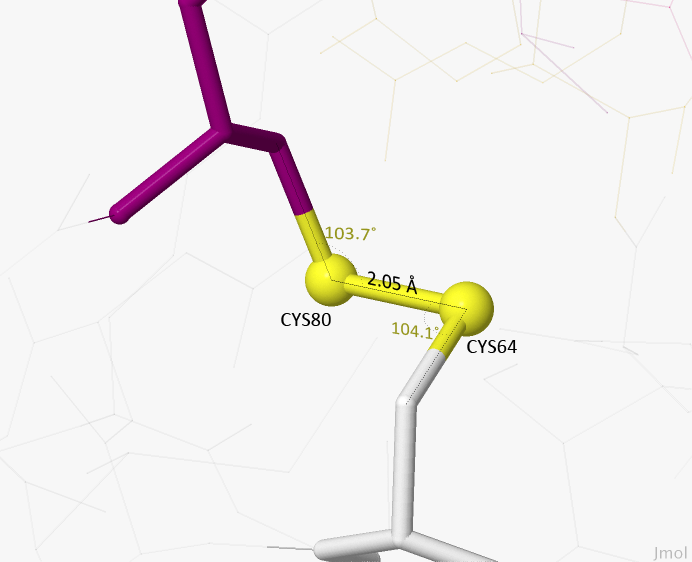
Рисунок 4. Дисульфидный мостик между остатком цистеина 64 и цистеина 80. Жёлтым цветом отмечен дисульфидный мостик и атомы серы. На рисунке отмечена длина дизульфидной связи, углы между связями. При наведении курсора появляется двугранный угол данной связи.
Рисунок и измерения получены с помощью программы J-mol.
Так как в дегидратазе не было обнаружено дисульфидных мостиков, был использован другой белок — лизоцим Ц-типа (lysozyme C) из организма Gallus gallus (курицы). Этот белок является антибактериальным агентом, который разрушает клеточные стенки бактерий с помощью гидролиза пептидогликана[1]. PDB-идентификатор — 1HC0. Скачать pdb-файл можно отсюда.
Для поиска S-S мостика была использована команда ssbonds. Изображение одного из дисульфидных мостиков из этого белка представлено на Рисунке 4. Мы видим, что длина связи равна 2,05 Å, а углы, характеризующие геометрию этой связи — 103.7° и 104.1°, двугранный угол связи равен 96.1°.
Водяной мостик
Водородный мостик представляет из себя водородную связь между аминокислотными остатками белка и водой.
Водяной мостик из белка дегидратазы изображён на Рисунке 5. Донором водорода является вода, а акцепторами — атомы кислорода боковой цепи аминокилотных остатков аспарагиновой кислоты.
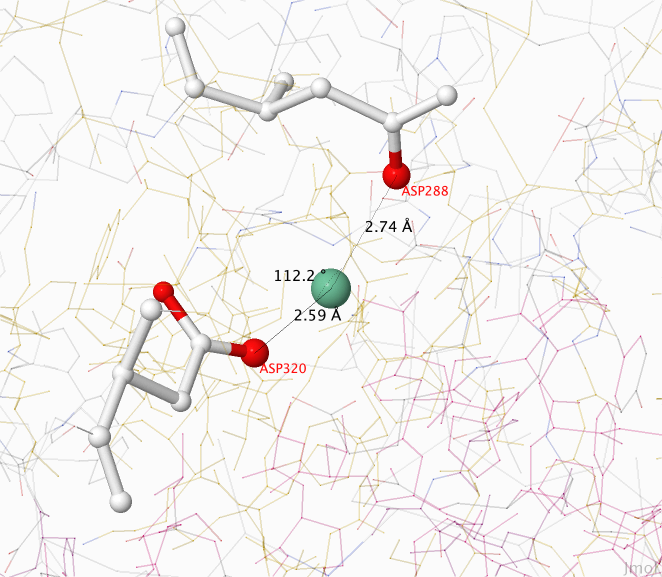
Рисунок 5. Водяной мостик. Красным цветом обозначены атомы кислорода, зелёным — молекула воды, чёрными линиями — водородные связи. На изображении отмечен угол между двумя водородными связями и и их длина в ангстремах.
Рисунок получен с помощью программы J-mol.