| « Внутримолекулярные взаимодействия боковых цепей |
Гидрофобные взаимодействия
Гидрофобные взаимодействия играют значительную роль в возникновении трёхмерной структуры белка. В результате взаимодействий радикалов аминокислот с водой неполярные гидрофобные радикалы стараются погрузиться внутрь белковой молекулы, а полярные радикалы, наоборот, ориентируются в сторону воды. В итоге возникает наиболее выгодная при данных условиях термодинамически конформация молекулы [1].
Гидрофобными атомами в белке являются все атомы углерода и серы, которые не связаны с полярными. Для их нахождения был снова использован данный Jmol скрипт. Гидрофобные атомы входят в группу hfprot. Это атомы серы и углерода, не связанные с полярными атомами, всех аминокислотных остатков, кроме серина, треонина, гистидина. На Рисунке 1 приведено изображение гидрофобных атомов в молекуле белка дегидратазы.
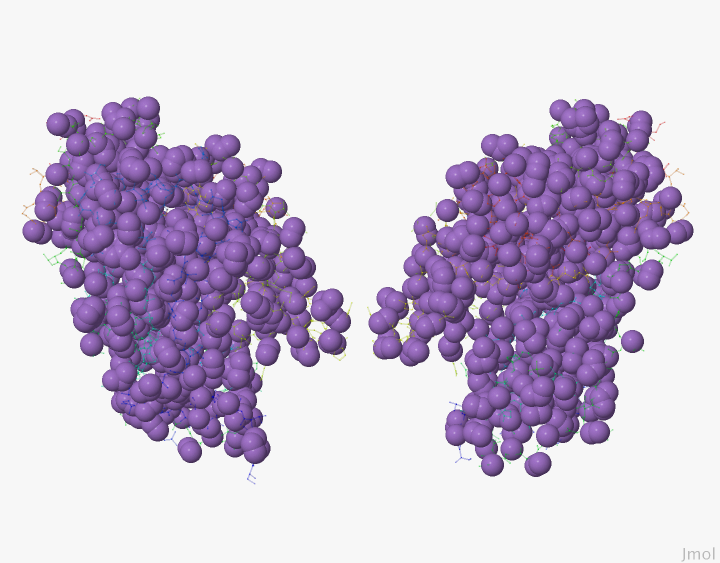
Рисунок 1. Гидрофобные атомы в дегидратазе. Фиолетовым цветом и в модели spacefill изображены гидрофобные атомы, остальные — в проволочной модели.
Изображение получено с помощью программы J-mol.
Гидрофобный кластер
Определить гидрофобный кластер мне самой не удалось, поэтому я воспользовалась сервисом CluD. CluD выделил 23 гидрофобных кластера, самый крупный из которых состоял из 431 атома. Изображение этого кластера представлено на Рисунке 2. Гидрофобные атомы находятся внутри молекулы белка, в то время как гидрофильные покрывают их.
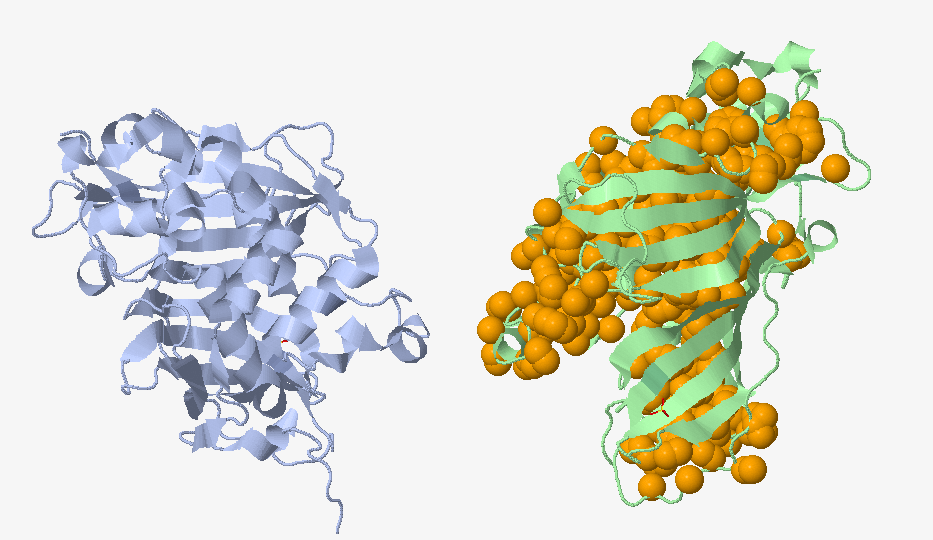
Рисунок 2. Гидрофобный кластер.
Оранжевым цветом обозначены гидрофобные атомы, входящие в кластер.
Рисунок получен с помощью java-апплета J-mol на сервисе CluD.
[1] Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник.– 3-е изд., перераб. и доп.– М.: Медицина, 1998.– 704 с.: ил.– (Учеб. лит. Для студентов мед. вузов). ISBN 5-225-02709-1