Атлас контактов
Введение
|
PKG (cGMP-зависимая белковая киназа или Белковая Киназа G) – это серин/треонин-специфическая белковая киназа,
которая активируется cGMP [1]((циклический гуанозинмонофосфат), представляющим собой циклический нуклеотид,
полученный из гуанозинтрифосфата (GTP) [2]).
Серин/треониновая белковая киназа действует как ключевой медиатор
пути передачи оксида азота (NO) / cGMP. GMP-связывание активирует PRKG1, который фосфорилирует серин и треонин
на многих клеточных белках. Многочисленные белковые мишени для фосфорилирования PRKG1 участвуют в модуляции клеточного кальция,
но вклад каждой из этих мишеней может существенно отличаться среди различных типов клеток.
PKG фосфорилирует ряд биологически важных мишеней и участвует в регуляции расслабления гладких мышц, функцонировании тромбоцитов,
метаболизме сперматозоидов, в делении клеток и синтезе нуклеиновых кислот. [3]
|
•PDB ID: 5J48
•Uniprot ID: Q13976
•Цепи: A, B (Рис.1)
•Длина последовательность (а.о.): 135
•Организм: Homo sapiens
•Имена генов: PRKG1 (PRKG1B, PRKGR1A, PRKGR1B) EC: 2.7.11.12
|
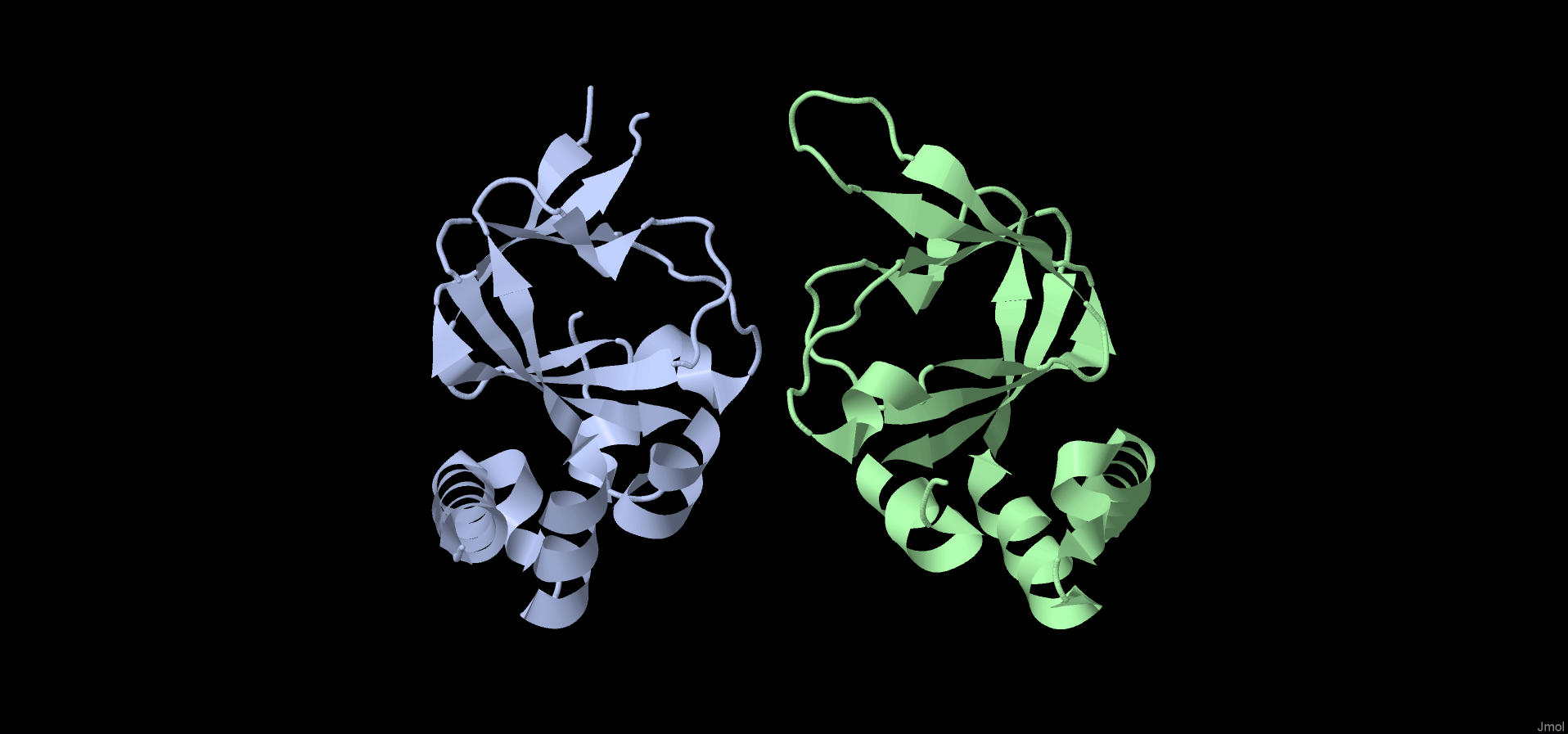 Рис.1. Структура белка, раскраска по цепям. Цепь A голубого цвета, цепь B – зелёного.
Рис.1. Структура белка, раскраска по цепям. Цепь A голубого цвета, цепь B – зелёного.
|
В составе молекулы имеется 4 лиганда: |
| 6FW | NA (ИОН НАТРИЯ) |
|---|
Название по IUPAC: 9-[(4aR,6R,7R,7aS)-2,7-dihydroxy-2-oxo-4a,6,7,7a-tetrahydro-4H-furo[3,2-d]
[1,3,2]dioxaphosphinin-6-yl]-2-amino-8-(4-chlorophenyl)sulfanyl-3H-purin-6-one
Химическая формула: Рис.2
Брутто-формула: C16H15ClN5O7PS
Молярная масса: 487.808 г/моль
PubChem ID:123969
|
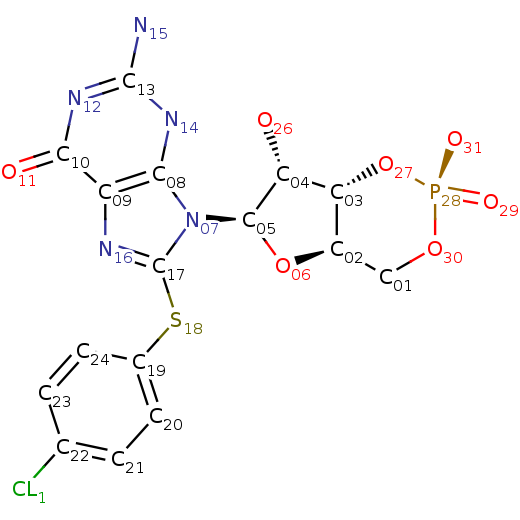 Рис.2. Структура 8-Pcpt-cgmp.
Рис.2. Структура 8-Pcpt-cgmp. |
Название по IUPAC: sodium(1+)
Химическая формула: Рис.3
Брутто-формула: Na+
Молярная масса: 22.99 г/моль
PubChem ID:923
|
 Рис.3. Ион натрия.
Рис.3. Ион натрия. |
| Ca (ИОН КАЛЬЦИЯ) | 1,2-ЭТАНДИОЛ (ЭТИЛЕНГЛИКОЛЬ) |
|---|
Название по IUPAC: calcium(2+)
Химическая формула: Рис.4
Брутто-формула: Ca+2
Молярная масса: 40.078 г/моль
PubChem ID:271
|
 Рис.4. Ион кальция.
Рис.4. Ион кальция. |
Название по IUPAC: ethane-1,2-diol
Химическая формула: Рис.5
Брутто-формула: C2H6O2
Молярная масса: 62.068 г/моль
PubChem ID:174
|
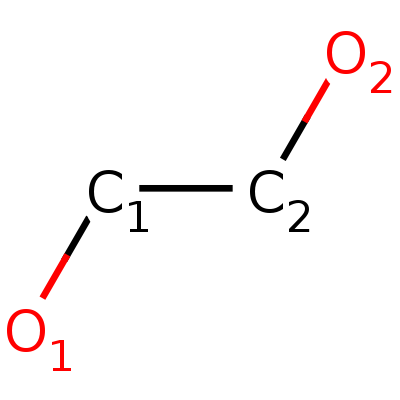 Рис.5. Структура этиленгликоля.
Рис.5. Структура этиленгликоля. |
|
Белок-белковые контакты
Солевые мостики – это комбинация двух видов нековалентных взаимодействий водородной и ионной связи.
Часто солевой мостик возникает между карбоксильной группой (RNH3+) радикала аспарагиновой или
глутаминовой кислоты и аминогруппой (RNHC(NH2)2+) радикала лизина или аргинина. [4]
Для поиска солевых мостиков была использована команда “restrict positive or negative”. Далее вручную
осуществлялся поиск подходящих контактов. После измерялась длина связи и, если она составляла
не более 4.0 A, то связь считается солевым мостиком.
Что интересно, 2 цепи исследуемого белка связаны между собой солевым мостиком (Рис.6).
А это может значить, что этот вид взаимодействия довольно прочный.
Еще в апплете представлены другие солевые мостики, которые находятся внутри одной цепи.
|
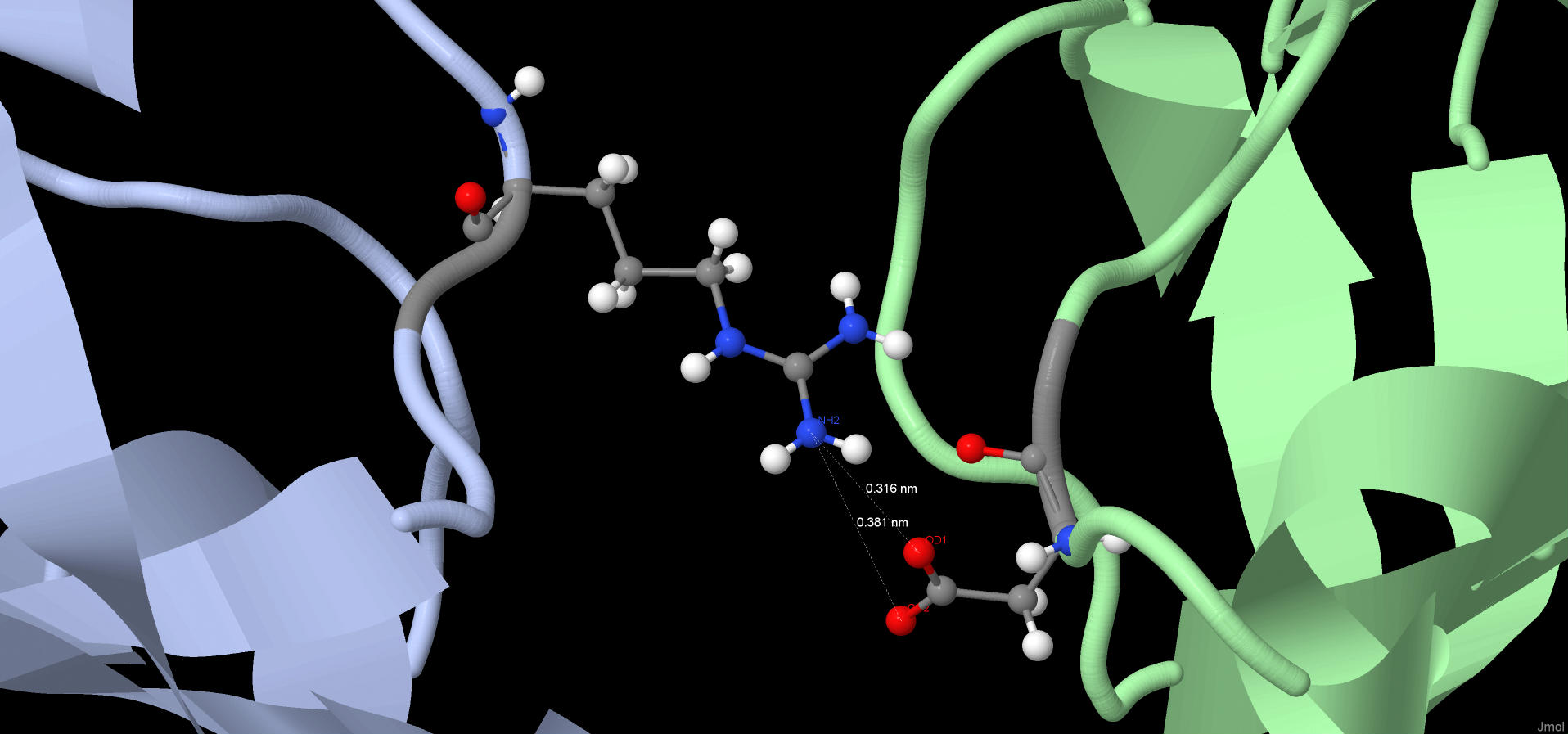 Рис.6. Солевой мостик между цепями белка.
Рис.6. Солевой мостик между цепями белка.
Голубым цветом обозначена – цепь A, зелёным – цепь B.
Красным – кислород, синим – азот.
|
|
Водородные связи
|
Согласно определению ИЮПАК, «водородная связь – это “привлекательное” взаимодействие между атомом водорода,
находящимся в составе молекулы, или между фрагментом молекулы X-H, в котором X – атом, более электроотрицательный,
чем водород, и атомом или группой атомов в той же или другой молекуле, в которых есть доказательство формирования связи». [5]
Формулировка весьма расплывчата, но на семинаре по биоинформатике мы обсуждали этот вопрос и решили считать,
что расстояние необходимое для образования водородной связи от 2 до 3,5 A и угол должен быть максимально приближен к 180°.
Для обнаружения водородных связей использовалась команда “hbonds calculate”. Всего в биомолекуле было найдено 466 водородных связей,
из которых 303 – водородные связи внутри белка (при длине белка 135 аминокислотных остатков).
Мы предполагаем, что такое большое количество связей (в 2,2 раза больше, чем аминокислотных остатков) необходимо
для стабилизации четвертичной структуры белка.
Также оказалось, что Jmol, посчитал солевые мостики водородной связью, что отчасти верно, но не совсем так,
стоит учитывать вклад ионного взаимодействия в образование солевых мостиков. При использовании команды “hbonds calculate”,
ионные мостики были обозначены, как водородные связи. А это значит, что количество подсчитанных программой водородных связей
в биомолекуле меньше, чем оно есть на самом деле.
В апплете представлены водородные связи между бета-листами и внутри одной альфа спирали.
|
|
|
|





