Атлас контактов
Водородные связи
Водородные связи, поддерживающие вторичную структуру молекулы, представляют особый интерес, когда они формируют 310-спираль, в которой между соединёнными водородной связью остатками расположены 3 аминокислоты, а не 4, как в привычной и более часто встречающейся альфа-спирали. В белках она, как правило, не достигает длины больше двух витков; при раскраске нашей АТФ-азы при помощи команды color structure мы увидели множество коротких фиолетовых спиралей.
Длина водородных связей (C-N, т.к. протоны в структуре не отражены) в такой спирали: [SER]209:F-[GLY]206:F 4.27Å, [GLU]101:C-[ILE]104:C 3.22Å, [HIS]415:D-[GLU]418:D 3.7Å, а в среднем 3.73Å. 310-спираль компактнее альфа-спирали и связи в ней напряжённее (в нашей структуре не изображены протоны, но измерение водородных связей в альфа-спирали дало среднее около 3Å, как и ожидалось). Измерения углов N-O-C для тех же водородных связей дали значения в 156.1, 132.3 и 157° соответственно, среднее значение – 148,5°, оно ниже чем ожидаемое среднее для альфа-спирали, опять же, потому что связи в 310-спирали более напряжены и углы между атомами более острые (ожидаемое значение угла 180-45=135, но полученное нами среднее значение слишком далеко от идеальных 180°). [3]
Водородные связи были обнаружены с помощью команды calculate hbonds, аих параметры вычислены с использованием measurements, аминокислоты, связи между которыми измерялись, подобраны вручную.
Стэкинг
С помощью команды restrict aromatic мы выделили ароматические аминокислотные остатки, способные участвовать в стекинг-взаимодействии, обусловленном перекрыванием p-орбиталей сопряжённых систем. Считается, что взаимодействия такого рода возможны, если между центрами сопряжённых систем расстояние не больше 12 ангстрем, а минимальное расстояние между атомами взаимодействующих ароматических структур 4.5-5Å. [4]
Мы вручную выбрали те остатки ароматических аминокислот, расстояние между которыми казалось минимальным, и измерили это расстояние, чтобы выяснить, возможно ли взаимодействие между ними, стараясь найти системы с как можно большим числом соединённых таким образом остатков, хотя чаще всего такие системы состоят из двух ароматических структур. Если аминокислоты гидрофобны, то система удерживается вместе ещё и за счёт гидрофобных взаимодействий, проявление которых возможно на этом расстоянии.
|
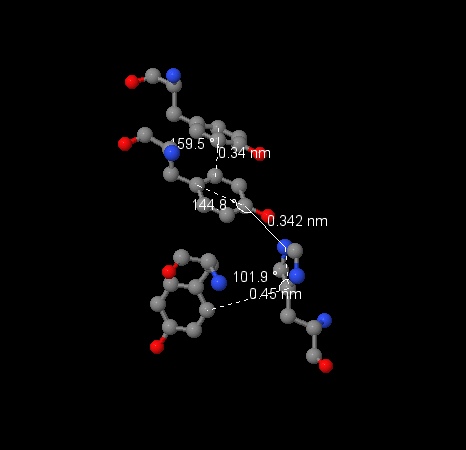
Мы обнаружили систему из четырёх аминокислотных остатков: [PHE]-437:D – [PHE]-409:D – [PHE]-453:D – [TYR]-445:D, минимальные расстояния между атомами, входящими в состав ароматической структуры, у них соответственно 3.91Å, 4.67Å и 4.86Å, что делает взаимодействие возможным. Углы между плоскостями колец равны: 141.0° между 437 и 409, 128.5° между 409 и 453, 135.8° между 453 и 445, то есть тип стэкинга – смещённый, потому что кольца не параллельны (обычный) и не перпендикулярны (Т-стэкинг). Другая система из четырёх аминокислотных остатков: [TYR]-171:G – [TYR]-78:G – [HIS]-107:G – [TYR]-113:G, минимальные расстояния между атомами 3.4Å, 3.42Å, 4.5Å, то есть достаточно мало, чтобы структуры взаимодействовали. Углы между плоскостями колец: 159.5°, 144.8°, 101.9°, мы вновь имеем дело со смещённым стэкингом, хотя последняя пара ароматических колец почти параллельна и вероятно, что между ними стэкинг близок к обычному. (эта система изображена на фотографии) |
Солевые мостики
Этот тип взаимодействия возникает между положительно и отрицательно заряженными боковыми цепями аминокислот в белке, оно имеет электростатический характер. Для образования солевого мостика расстояние между атомами не должно превышать 4Å. Аминокислоты с положительно заряженными радикалами, способными к образованию мостиков – аргинин, лизин и гистидин, а с отрицательно заряженными радикалами – аспартат и глутамат. Солевые мостики можно искать вручную, выделяя разными цветами положительно и отрицательно заряженные аминокислоты и высчитывая расстояния между их заряженными группами, но я использовала онлайн-ресурс Protein Interaction Calculator [5].
|
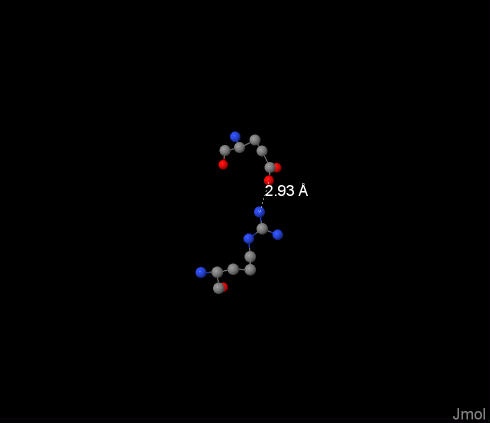
Солевой мостик был обнаружен между 122:U-Arg и 391:P-Glu, его длина составила 2.93Å, он изображён на фотографии. Это расстояние достаточно мало, чтобы взаимодействие между заряженными группами состоялось. Солевые мостики вносят значимый вклад в поддержание третичной структуры белка, во многом определяют форму молекулы в целом и активного сайта в частности. |
Взаимодействие между атомом серы и ароматическим кольцом
Такого рода связи возникают между аминокислотами с ароматическими кольцами в боковых цепях (фенилаланин, тирозин, триптофан) и остатками, содержащими атом серы. Причины их возникновения не до конца изучены, хотя существует множество гипотез, их объясняющих. Атом серы легко поляризуем, потому что у него есть заполненные 3p и свободные 3d орбитали, что делает его хорошим постоянным диполем, то есть это взаимодействие по природе схоже с Ван-дер-Ваальсовым, но оно сильнее. [6] Такие взаимодействия поддерживают третичную структуру белка, связывая между собой различныеучастки аминокислотной цепи.
|
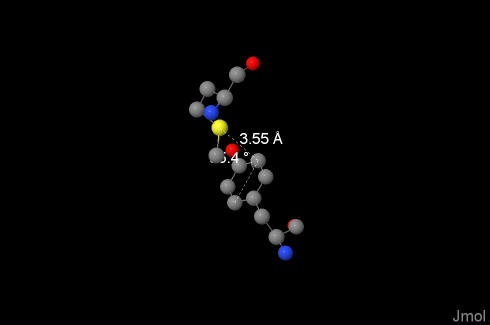
В нашей молекуле они были обнаружены при помощи упоминавшегося выше онлайн-ресурса, а потом нужные аминокислоты, между которыми такие связи существуют, были найдены в структуре белка. Например, такой мостик образуется между остатками 199:R-Tyr и 137:N-Met и изображён на картинке. Его длина, рассчитанная мною по расстоянию между атомом серы и ближайшим к нему атомом бензольного кольца составляет 3.55Å, угол между связью и плоскостью кольца 154.23° (рассчитано онлайн). Взаимодействие между атомом серы и ароматической системой возможно на расстоянии до 6Å, так что оно действительно имеет место. [7](изображено на фотографии) |
Взаимодействие между сопряжённой Pi-системой и катионом
Связь между Pi-системой и катионом возникает, если на расстоянии 6Å от поверхности ароматического кольца, входящего в состав фенилаланина, тирозина или триптофана, появляется положительно заряженный ион. Сопряжённая система ароматического кольца несёт частично негативный заряд благодаря делокализации pi электронов. Катионы, например, боковые цепи лизина и аргинина, положительно заряженные лиганды или катионы металлов, вступают в кулоновское взаимодействие с этим негативным зарядом.
|
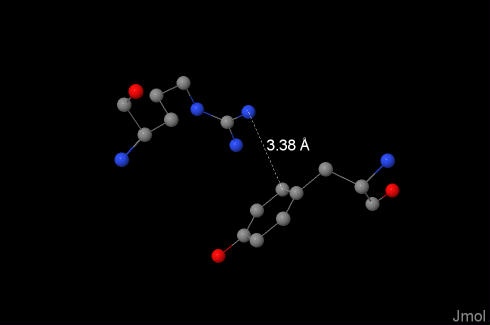
Эти связи во многом определяют третичную структуру белков, возможность межмолекулярных контактов и взаимодействия с лигандами. В нашем белке они были обнаружены, например, между 19:O-Tyr и 171:V-Arg, при этом использовался упоминавшийся выше онлайн-ресурс. Расстояние между положительно заряженным атомом азота в аргинине и бензольным кольцом тирозина составило 3.38Å. |
Jmol-апплет, отображающий показанные взаимодействия
|
|
Скачать скрипты
Источники (дополнение к указанным на основной странице практикума)
3. Основы биохимии Ленинджера: в 3т. Т.1: Строение и катализ
4. www.jbc.org/content/273/25/15458.long
5. pic.mbu.iisc.ernet.in
6. www.ncbi.nlm.nih.gov/pmc/articles/PMC4972207/
7. Sulphur-aromatic interactions in proteins, K.S.C.Reid P.F.Lindley J.M.Thornton
8. Gallivan JP, Dougherty DA. Cation-pi interactions in structural biology. Proc Natl Acad Sci U S A. 1999 Aug 17;96(17):9459-64. PMID:10449714

