Общая характеристика структуры 2OPA
Идентификатор PDB: 2OPA
Название белка: бинарный комплекс 4-оксалокронат таутомеразы с 2-фтор-3-(4-гидроксифенил)-2-пропеноловой кислотой (YWHB binary complex with 2-fluoro-p-hydroxycinnamate)
Количество разных цепей в PDB-файле: 2 цепи - A и B.
PDB-файле есть координаты молекул, отличных от собственно белка и воды: одна молекула 2-фтор-3-(4-гидроксифенил)-2-пропеноловой кислоты (2-fluoro-3-(4-hydroxyphenyl)prop-2-enoic acid, 2-fluoro-p-hydroxycinnamate, также известна как 1mfi, FHC).
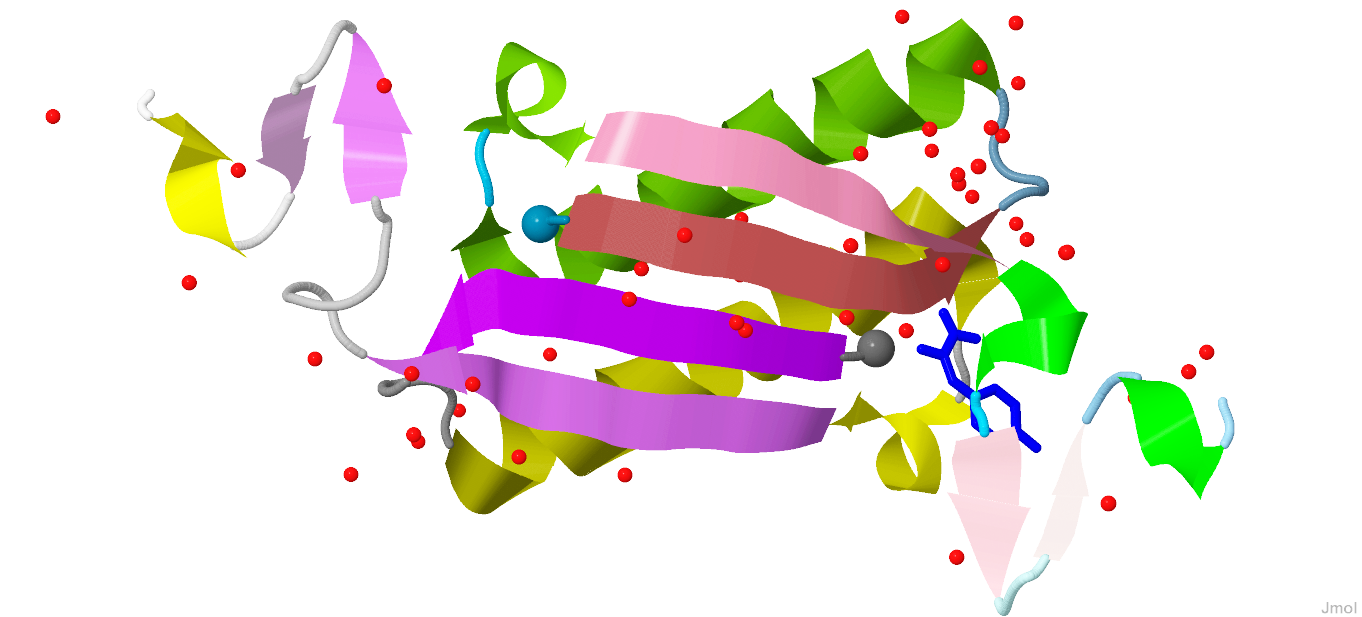
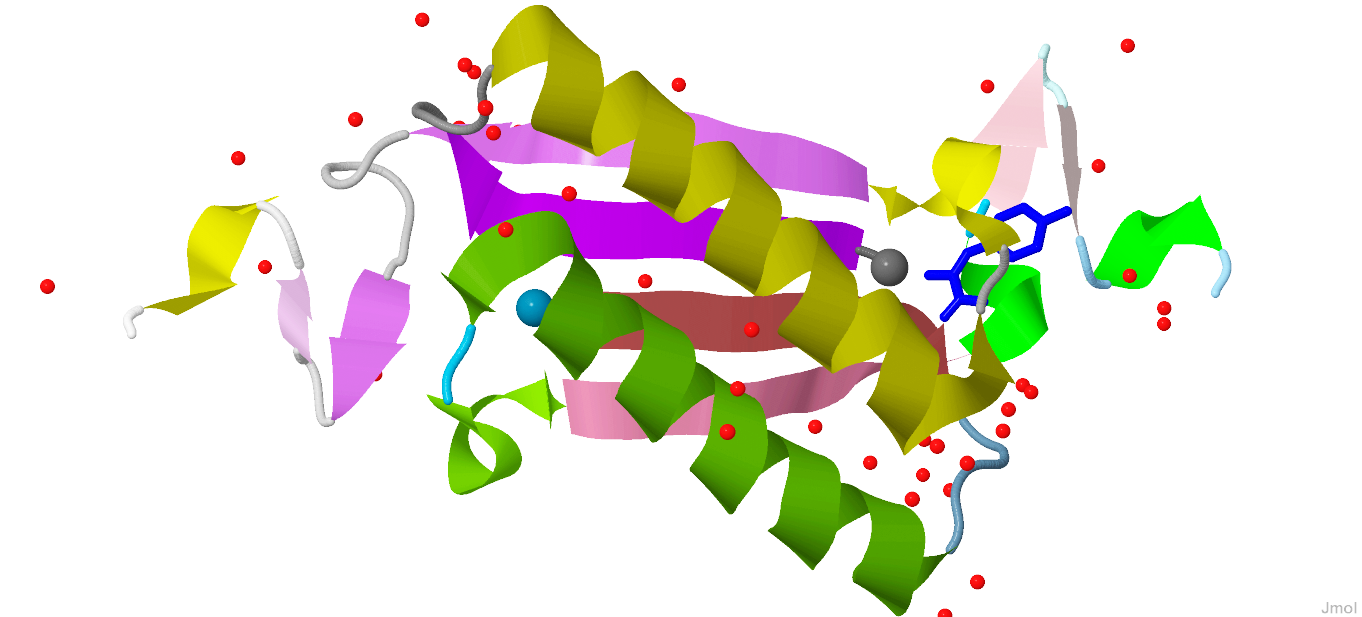
Общий вид белка показан на рисунках 1 и 2.
Рис. 1 и 2. Вид белка с разных ракурсов. Цепи белка светлеют по направлению к С-концам, N-концы цепей выделены шариком. Цветовая схема изображения представлена в таблице 1.Таблица 1. Цветовая схема белка.
| Элемент | Цвет в цепи A | Цвет в цепи B | Форма |
|---|---|---|---|
| Альфа-спираль | Зеленый | Желтый | Спираль |
| Бета-лист | Розовый | Фиолетовый | Лента со стрелкой |
| Петля | Голубой | Серый | Трубочка |
| Структуры, не входящие в состав самого белка | |||
| Молекула воды | Красный | Шарик | |
| Молекула fhc | Синий | Шестиугольник с палочками | |
Анализ структуры альфа-спиралей и бета-листов в цепи B белка с кодом PDB 2OPA.
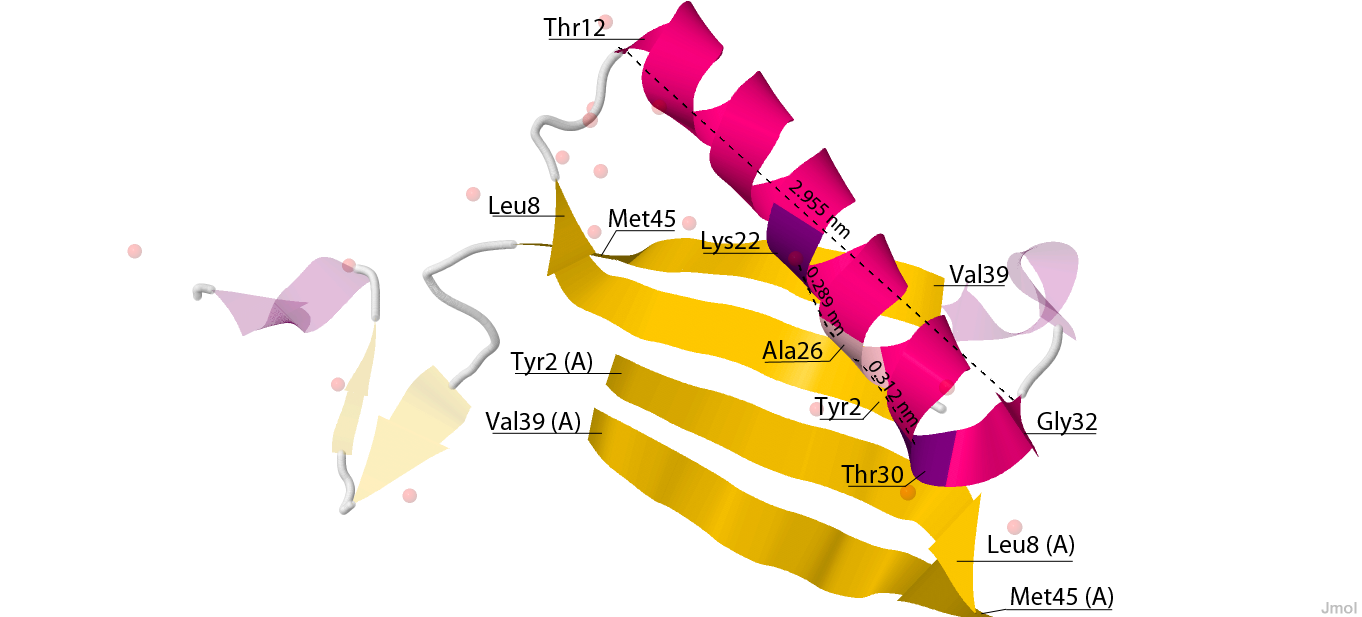
Выбрала в структуре одну альфа-спираль и один бета-лист, состоящий четырех бета-тяжей. Показала на рисунке позицию выбранной спирали и листа на цельной структуре цепи белка (рис.3). На рисунке указаны соответствующие номера остатков напротив начала и конца каждого из элементов (спирали и каждого тяжа листа).
Рис. 3. Альфа-спираль и бета-лист, состоящий четырех бета-тяжей. Желтым цветом показан бета-лист, малиновым выделена альфа-спираль цепи B, остальная часть цепи B для наглядности прозрачна. У каждого бета-тяжа и спирали указаны остатки начала и конца (часть бета-листа находится в цепи A, что также подписано рядом с аминокислотным остатком).
Для выбранной спирали выяснила следующие параметры:
- Шаг спирали (средний) равен 5.3731. Длина спирали (показана на рисунке 3) поделена на количество витков (5.5):
29.55209 : 5.5 = 5.3731
- Число остатков спирали на один виток равно 3.818. Количество остатков в спирали поделено на количество витков:
21 : 5.5 = 3.818
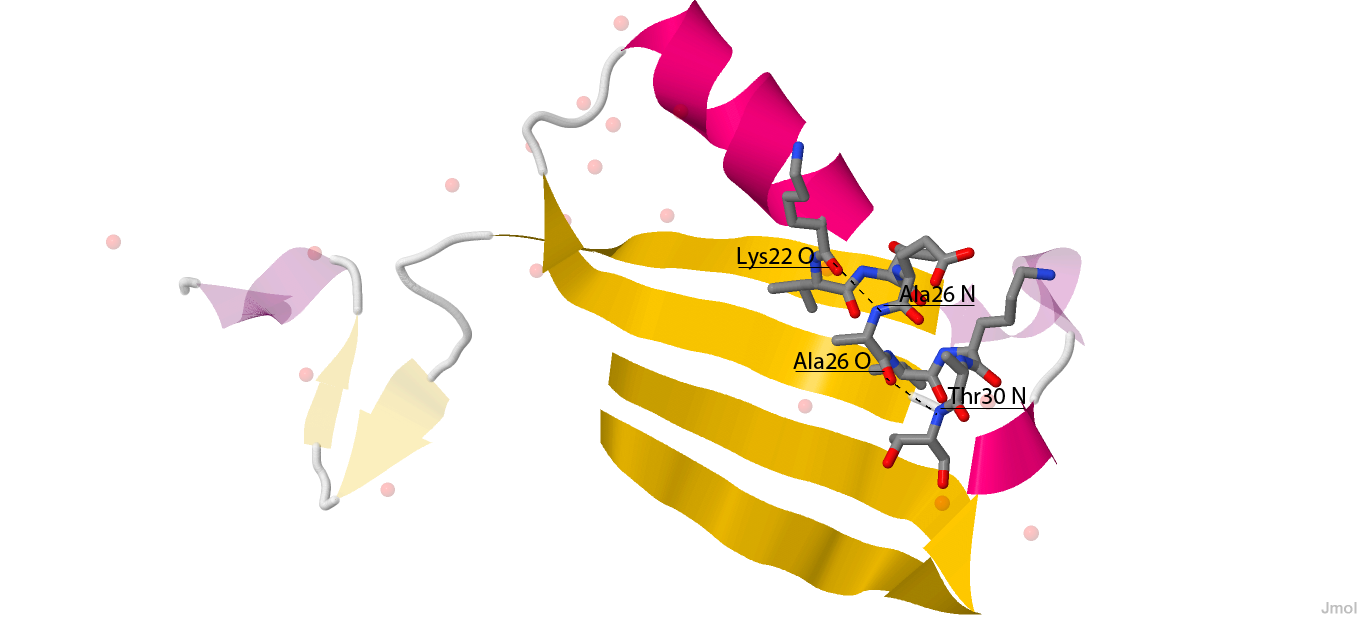
- Остаток с номером n образует водородные связи с остатками n+4 и n-4. Пример: на рисунке 3 и 4 показаны водородные связи остатка 26.
Рис. 4. Водородные связи остатка 26. Пунктиром обозначены водородные связи, подписаны атомы (и содержащие их остатки), участвующие во взаимодействии.
Для выбранного листа выяснила следующие параметры:
- В этом листе есть параллельные и антипараллельные бета-тяжи. Параллельными тяжами считаются те тяжи, которые направлены в одну сторону, антипараллельными - в разные стороны.
- Лист образует спирально закрученную плоскость, что видно на рисунке 5.
Рис. 5. Выбранный бета-лист в двух ракурсах.
Внутримолекулярные взаимодействия боковых групп белка структуры 2OPA.
Для поиска дисульфидных мостиков нужно найти цистеиновые остатки. Их в данном белке нет (командой JMol выделено 0 атомов), а значит, нет и дисульфидных мостиков.
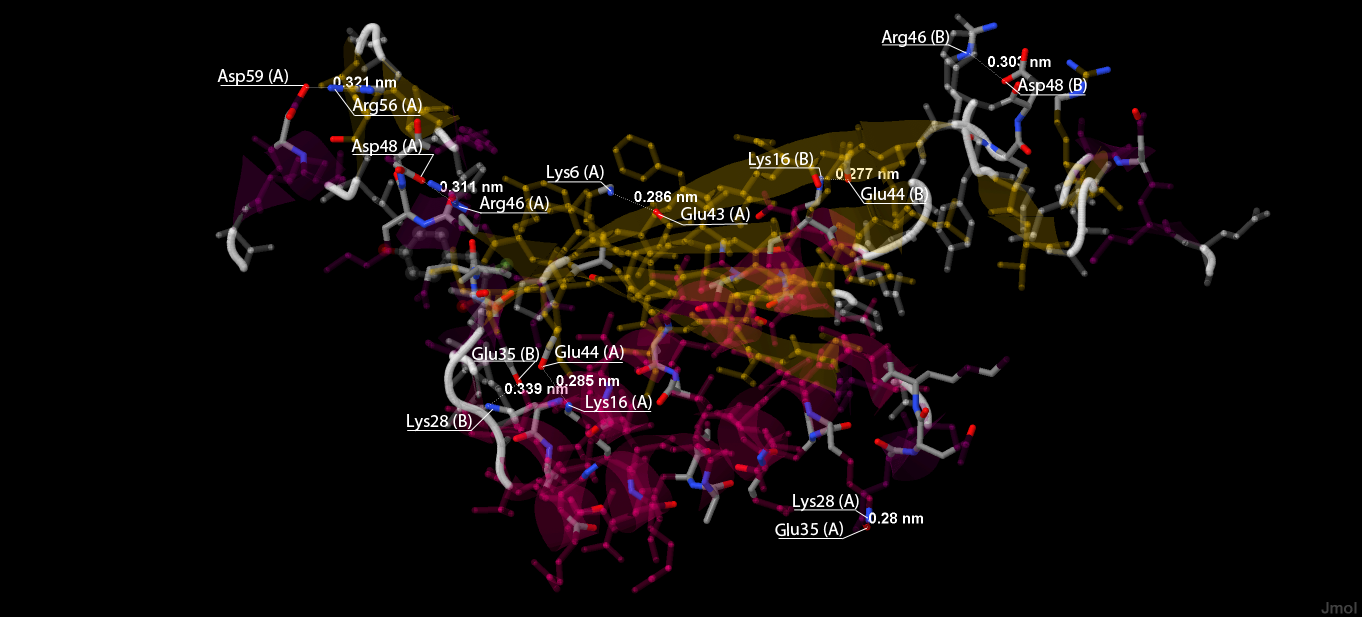
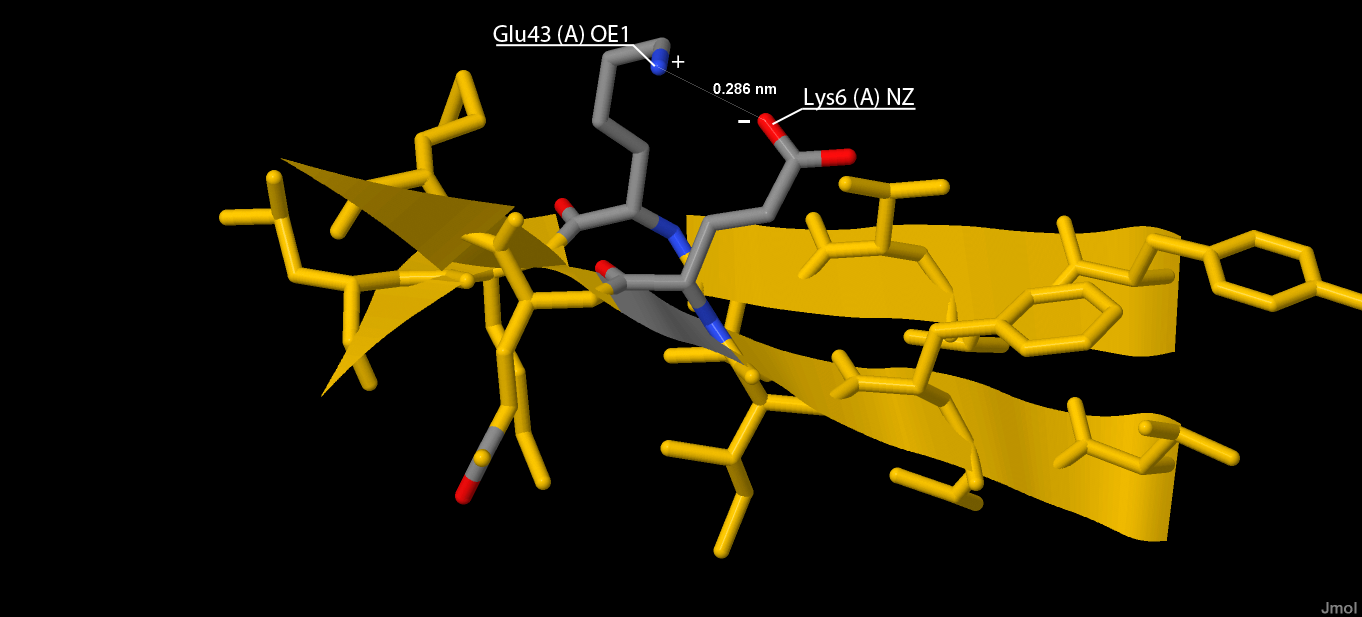
В данном белке есть солевые мостики, они образуются между отрицательно и положительно заряженными аминокислотами (их заряженными частями). Для их поиска ищем все положительно заряженные аминокислоты и отрицательно заряженные аминокислоты, находящиеся на расстоянии 2.5-3.5 ангстрема друг от друга. Найденные солевые мостики показаны на рисунке 6, отдельный солевой мостик показан крупно на рисунке 7.
Рис. 6. Солевые мостики в белке. Подписаны номера остатков, их образующих, и расстояние между ними.
Рис. 7. Солевой мостик между Glu43 и Lys6.