Главная страница > Четвертый семестр > Мембранные белки
Рассмотрен главный внутренний белок волокнистых клеток хрусталика (MIP, Major Intrinsic Protein of eye lens fiber) из организма Mus musclulus. Запись UniProt/SwissProt, соответствующая рассмотренному белку, имеет код доступа Q640N8. По данным GOA, MIP Mus musculus является интегральным мембранным белком (GO:0016021, автоматическое предсказание функции по гомологии) и выполняет функцию аквапорина (GO:0015250, по результатам анализа последствий мутаций гена белка). Последовательность MIP Mus musculus была получена из SwissProt с помощью команды seqret:
seqret sw:Q640N8 Q640N8.fasta
Для проверки предсказаний трансмембранных участков MIP Mus musculus была использована трехмерная структура одного из ближайших гомологов (подтверждение гомологичности см. ниже) — MIP Ovis aries (PDB ID 1SOR, UniProt/SwissProt AC Q6J8I9), полученная путем анализа дифракции электронов. Структура и соответствующая последовательность (в FASTA-формате) были получены на сайте БД PDB, для получения последовательности из UniProt/SwissProt была использована команда seqret (синтаксис см. выше). Выравнивание последовательностей MIP из pdb-файла и записи UniProt, построенное с помощью программы needle, показало, что трехмерная структура 1SOR не содержит информации о 4-х N-концевых и 24-х C-концевых аминокислотных остатках. Команда, с помощью которой была запущена программа needle, приведена ниже:
needle Q6J8I9.fasta 1SOR.fasta prototype.txt
По данным Gonen et al. (2005), при проведении анализа трехмерной структуры использовался очищенный MIP Ovis aries. В связи с тем, что in vivo имеет место частичный протеолиз MIP (с обоих концов), необходимый для образования им межклеточных контактов* (Ball et al., 2004; Gonen et al., 2004), выделенный MIP короче предшественника, последовательность которого приведена в UniProt.
Выравнивание MIP Mus musculus и MIP Ovis aries (последовательность из pdb-файла), построенное с помощью программы muscle**, показало высокое сходство их последовательностей (идентичность перекрывающегося участка составляет приблизительно 95%, гэпы только концевые). MIP Mus musculus из UniProt, по-видимому, также является предшественником (N- и C-концевые участки не отщеплены). Высокое сходство последовательностей MIP из разных организмов и выполнение ими одинаковых функций позволяет рассматривать эти белки как ортологи.
Информация о трансмембранных участках MIP Ovis aries взята из БД мембранных белков OMP. Рассматриваемый белок представляет собой
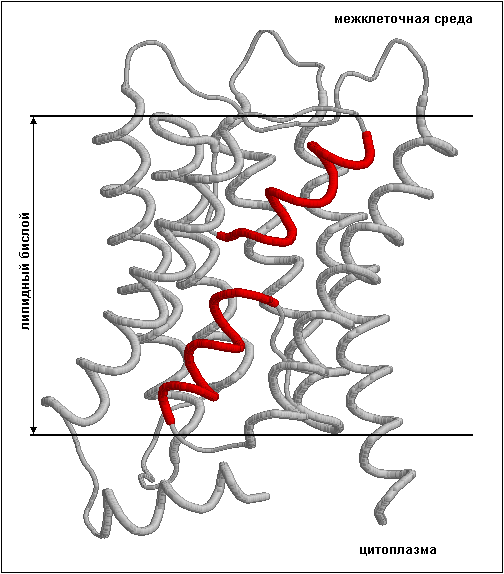
гомотетрамер, каждая из субъединиц которого включает в себя по 8 α-спиральных мембранных участков. Шесть из них (кроме 3-го и 7-го) имеют длину, приблизительно равную 20 а.о., и полностью пронизывают липидный бислой. Два мембранных участка (3-й и 7-й) имеют меньшую длину (около 10 а.о.) и, по данным pdb-файла 1sor, пронизывают только внутренний и наружный липидный слои мембраны соответственно. Данные α-спиральные мембранные участки с N-концов фланкированы мембранными участками длиной 6 и 8 а.о. соответственно, не имеющими α-спиральной структуры. На рис. 1 представлена трехмерная структура MIP Ovis aries с выделенными короткими α-спиральные мембранные участками. Выравнивание последовательностей MIP Ovis aries (из pdb-файла) MIP Mus musculus (из UniProt) с размеченными участками приведено на рис. 2 (см. также выравнивание в формате aln).

Рис. 1. Трехмерная структура MIP Ovis aries (по результатам анализа дифракции электронов). Красным цветов выделены короткие
α-спиральные мембранные участки.
Рис. 2.
Выравнивание последовательностей MIP Ovis aries (1SOR) MIP
Mus musculus
(Q640N8).
Строка OPM соответствует
экспериментально установленной структуре
MIP Ovis aries
по данным OPM ("H"
— мембранная α-спираль, "+" —
цитоплазматическая петля, "-" — внешняя петля, "M"
— неспиральный мембранный участок, "?" —
остаток отсутствует в составе последовательности MIP Ovis aries).
Предсказание мембранных участков MIP mus musculus проведено с помощью программы TMHMM (Krogh et al., 2001). Для предсказания топологии белков данная программа использует скрытые марковские модели (Hidden Markov Models, HMM). Модель включает 7 типов состояний, соответствующих аминокислотным остаткам белков, входящим в состав участков с различной топологией:
глобулярный цитоплазматический участок,
цитоплазматическая петля (фланкирует трансмембранные участки, до 20 а.о.),
цитоплазматический концевой участок трансмембранной
трансмембранная α-спираль,
внешний концевой участок трансмембранной α-спирали,
внешняя петля (фланкирует трансмембранные участки, до 20 а.о.),
внешний глобулярный участок.
Свободными параметрами модели являются вероятности переходов из состояния в состояние, которые представляют собой функции от аминокислотной последовательности. В процессе обучения на выборке из 165 мембранных белков с известной топологией вероятности переходов были подобраны таким образом, чтобы обеспечить наилучшее согласование модели и последовательностей выборки (в соответствии с заданным критерием). При проведении предсказания в зависимости от аминокислотной последовательности исследуемого белка выбирается наиболее вероятный маршрут через марковскую цепь, на основе которого реконструируется топология белка. Преимущество скрытых марковских моделей перед другими методами предсказания топологии заключается в возможности одновременного учета
профилей гидрофобности,
правила Хейне,
длины трансмембранных участков и
прочих особенностей аминокислотного состава различных участков белков (в том числе сигнальных участков котрансляционной транслокации через мембрану)
одной моделью с уже разработанным алгоритмом реализации (скрытые марковские модели используются при решении множества других задач, например, при поиске удаленных гомологов — профили HMM). Процент правильных предсказаний программы TMHMM составляет 77-78%.
Результаты предсказания топологии MIP Mus musculus приведены на рис. 3 (см. также выравнивание в формате aln).
Рис. 3. Выравнивание последовательностей MIP Ovis aries (1SOR) MIP Mus musculus (Q640N8). Строка OPM соответствует экспериментально установленной структуре MIP Ovis aries по данным OPM("H" — мембранная α-спираль, "+" — цитоплазматическая петля, "-" — внешняя петля, "M" — неспиральный мембранный участок, "?" — остаток отсутствует в составе последовательности MIP Ovis aries), строка TMHMM — предсказанной с помощью TMHMM топологии MIP Mus musculus (обозначения те же).
В связи с тем, что поcледовательности MIP Mus musculus и Ovis aries являются идентичными на 95%, можно считать, что топология MIP Ovis aries характерна и MIP Mus musculus (структуры являются более консервативными, чем последовательности). Таким образом, справедливо сравнение предсказанной топологии и топологии, восстановленной на основе выравнивания поcледовательностей, с целью оценки качества предсказаний TMHMM. С помощью программы был проведен подсчет значений true positive, true negative, false positive, false negative и выражающихся через них для перекрывающегося участка последовательностей MIP Mus musculus и MIP Ovis aries из pdb-файла (табл. 1, перед проведением подсчета строки выравниваний, соответствующие экспериментально установленной и предсказанной топологиям были экспортированы в FASTA-формате).
В целом программа TMHMM верно предсказала шесть трансмембранных (пронизывающих липидный бислой) α-спиральных участков и расположение цитоплазматических петель (см. выдачу программы). Короткие (10 а.о.) α-спиральные участки, фланкированные только цитоплазматической, либо только внешней петлей, предсказаны не были. Это объясняется отсутствием соответствующих состояний в используемой для предсказаний марковской модели (модель рассматривает трансмембранные участки, состоящие приблизительно из 20 а.о. и фланкированные с одной стороны цитоплазматическими, а с другой — внешними петлями, см. выше). Достаточно высокие значения sensitivity (чувствительность), specificity (специфичность), precision (точность), а также низкое сверхпредсказание говорят о приемлемости применения TMHMM для предсказания топологии белков, единственными мембранными элементами которых являются трансмембранные α-спирали. Более высокое недопредсказание (28%) объясняется наличием коротких мембранных α-спиральных участков.
Табл. 1. Результаты предсказания топологии мембранного белка MIP Mus musculus с помощью TMHMM.
| Число аминокислотных остатков | |
|
всего а.о. TP + FP + TN + FN |
235 |
|
остатки,
предсказанные как локализованные в мембране TP + FP |
138 |
| true positive (TP) | 121 |
| false positive (FP) | 17 |
| true negative (TN) | 70 |
| false negative (FN) | 27 |
|
чувствительность (sensitivity) TP / (TP + FN) |
82% |
|
специфичность (specificity) TN / (TN + FP) |
80% |
|
точность (presision) TP / (TP + FP) |
88% |
|
сверхпредсказание FP / (FP + TP) |
12% |
|
недопредсказание FN / (FN + TN) |
28% |
Для проверки выполнения правила Хейне* с помощью GENEDOC (пункт меню Reports / Base Composition Report) был проведен подсчет содержания положительно заряженных аминокислотных остатков (K и R) в цитоплазматических и внешних петлях MIP Ovis aries. При подсчете использовались данные экспериментально установленной структуры.
Было подсчитано, что 8 аминокислотных остатков цитоплазматических петель представляют собой остатки аргинина или лизина, тогда как среди остатков внешних петель остатками аргинина или лизина является только 3. Таким образом, цитоплазматические петли содержат больше положительно заряженных аминокислотных остатков, чем внешние (сравнивается суммарное количество положительно заряженных аминокислотных остатков, а не их относительное содержание, так как ориентация белка в мембране определяется суммарным зарядом петель). Следовательно, правило Хейне выполняется.
Сходным образом было проверено выполнение правила Хейне для предсказанной с помощью TMHMM топологии MIP Mus musculus. Было подсчитано, что 11 аминокислотных остатков цитоплазматических петель и 3 аминокислотных остатка внешних петель представляют собой остатки аргинина или лизина. Следовательно, суммарное содержание положительно заряженных остатков в цитоплазматических петлях по предсказанию TMHMM выше, чем во внешних петлях, то есть правило Хейне также выполняется (правило Хейне учитывается программой при предсказании топологии, см. выше).
Профиль гидрофобности для последовательности белка MIP Mus musculus был построен с помощью программы pepwindow пакета EMBOSS (размер окна принят равным 19 а.о., см. выдачу программы). Запуск pepwindow был осуществлен следующей командой:
pepwindow Q640N8.fasta -graph data -length 19 -auto
Выдача программы pepwindow была импортирована в Excel (см. книгу pepwindow.xls). Построенный профиль гидрофобности представлен в виде графика на рис. 4. Результаты предсказания топологии MIP Mus musculus по профилю гидрофобности* приведены на рис. 6 (
использовалось пороговое значение 1.70, см. также выравнивание в формате aln). Проведен подсчет значений true positive, true negative, false positive, false negative и выражающихся через них для перекрывающегося участка последовательностей MIP Mus musculus и MIP Ovis aries из pdb-файла (табл. 2, при подсчете использовалась программа).В целом по профилю гидрофобности были правильно предсказаны четыре из восьми трансмембранных
α-спиральных участков (на два меньше, чем с помощью TMHMM). Короткие (10 а.о.) мембранные α-спирали предсказаны не были, что может быть связано с размером окна (19 а.о., то есть при построении профиля гидрофобность данных участков нивелируется гидрофильными цитоплазматическими или внешними петлями, фланкирующими участки). При уменьшении размеров рамки до 9 а.о. на графике появляются пики, соответствующие коротким мембранным участком, однако уширение пиков, соответствующих трансмембранным α-спиралям, затрудняет предсказание их расположения в последовательности (рис. 5). Кроме того, не были предсказаны две C-концевые трансмембранные спирали длиной 20 а.о. Для того, чтобы их предсказать, надо понизить порог до 1.45, однако это приведет к чрезмерному удлиннению четырех выявленных трансмембранных спиралей (например, длина второй трансмембранной спирали увеличится приблизительно до 30 а.о.).Значительно более низкие значения параметра true positive (78 вместо 121) и более высокие значение параметра false negative (70 вместо 21) говорят о том, что предсказания, сделанные по профилю гидрофобности, по качеству хуже предсказаний TMHMM. Различие в качестве предсказаний связано с тем, что при выбранном пороговом значении (1.70) по профилю гидрофобности не удалось предсказать две трансмембранные спирали длиной приблизительно по 20 а.о. Соответственно, параметры, выражающиеся через TP и FN, также значительно отличаются для двух предсказаний (в том числе чувствительность составляет 53% вместо 82%, недопредсказание - 46% вместо 28%). Различия в качестве предсказаний вероятно связаны с тем, что помимо профилей гидрофобности TMHMM учитывает и другие особенности аминокислотного состава (см. выше).
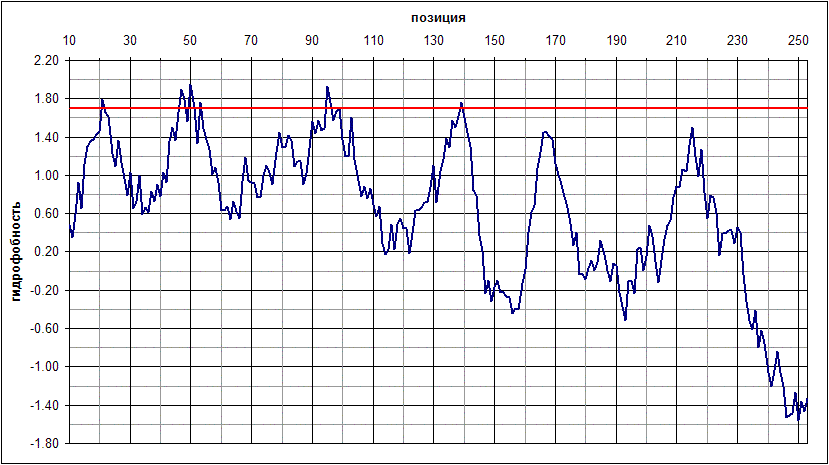
Рис. 4. Профиль гидрофобности MIP Mus musculus. Горизонталь, соответствующая выбранному пороговому значению 1.70, показана красной линией.
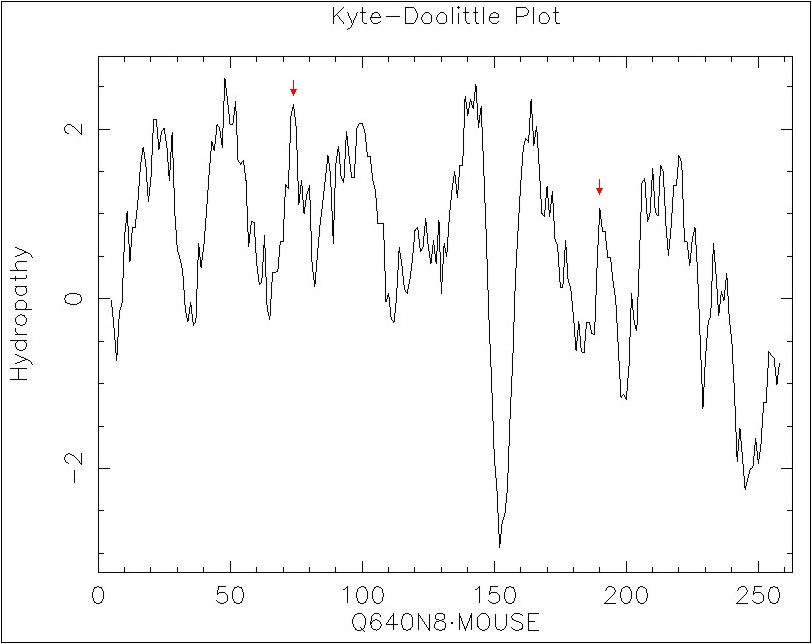
Рис. 5. Профиль гидрофобности MIP Mus musculus (использовалась рамка шириной 9 а.о., изображение получено с помощью программы pepwindow). Пики, соответствующие коротким мембранным
α-спиралям, отмечены стрелками.
Рис. 6. Выравнивание последовательностей MIP Ovis aries (1SOR) MIP Mus musculus (Q640N8). Строка OPM соответствует экспериментально установленной структуре MIP Ovis aries по данным OPM("H" — мембранная α-спираль, "+" — цитоплазматическая петля, "-" — внешняя петля, "M" — неспиральный мембранный участок, "?" — остаток отсутствует в составе последовательности MIP Ovis aries), строка manual — предсказанной по профилю гидрофобности топологии MIP Mus musculus (обозначения те же).
Табл. 2. Результаты предсказания топологии мембранного белка MIP Mus musculus по профилю гидрофобности.
| Число аминокислотных остатков | |
|
всего а.о. TP + FP + TN + FN |
235 |
|
остатки,
предсказанные как локализованные в мембране TP + FP |
83 |
| true positive (TP) | 78 |
| false positive (FP) | 5 |
| true negative (TN) | 82 |
| false negative (FN) | 70 |
|
чувствительность (sensitivity) TP / (TP + FN) |
53% |
|
специфичность (specificity) TN / (TN + FP) |
94% |
|
точность (presision) TP / (TP + FP) |
94% |
|
сверхпредсказание FP / (FP + TP) |
6% |
|
недопредсказание FN / (FN + TN) |
46% |
© Куравский Михаил Львович, 2007