Общая характеристика структуры 1XTM
- Идентификатор PDB: 1XTM
- Название белка: супероксиддисмутазо-подобный белок yojM (hypothtical superoxide dismutase-like protein YOJM)
- В PDB-файле содержится 2 цепи (A,B), соответствующие разным формам белка (Y88H и P104H)
- В PDB-файле также указаны координаты лигандов:
- В А-цепи 1 ион меди Cu2+ (503) и 1 ион цинка Zn2+ (504)
- В B-цепи 1 ион меди Cu2+ (500) и 4 иона цинка Zn2+ (501,502,505,506)
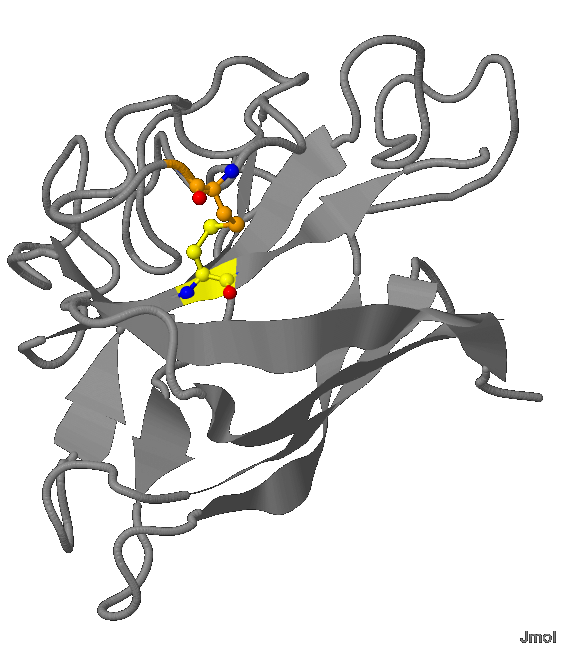
Наглядное изображение вторичной структуры белка представлено на рис. 1
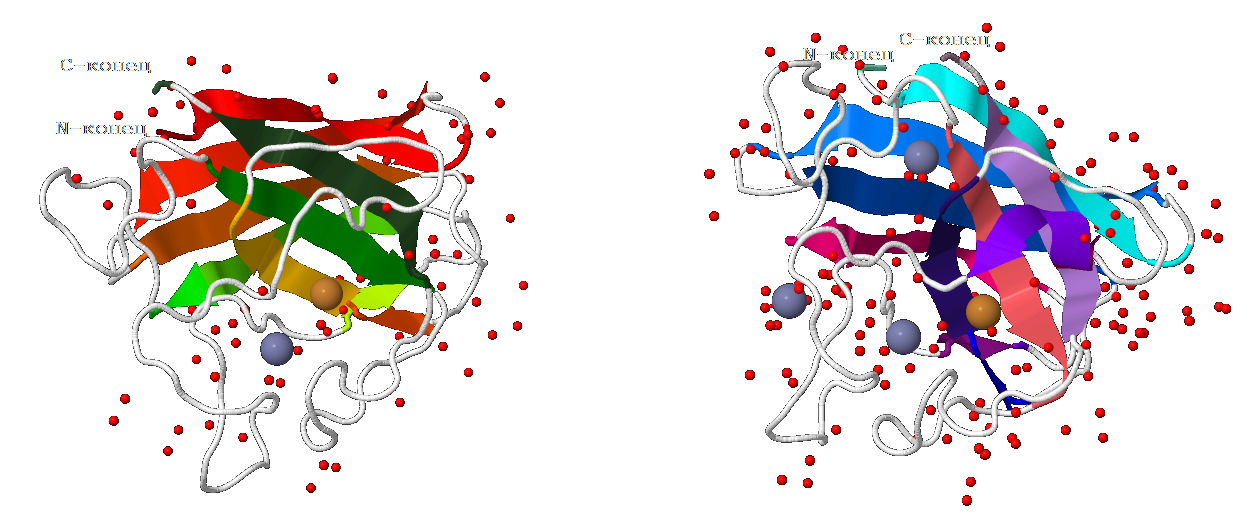 Рис.1 Структура белка. Движение цепи
Рис.1 Структура белка. Движение цепи Общее: коричневым цветом обозначены атомы меди, серым - атомы цинка; красным - молекулы воды; лентами - β-листы; белыми нитями - остальные части белка
Движение цепи белка отображено с помощью последовательности цветов:
Цепь А: N-конец бордового цвета » β-тяжи красного цвета » алого » тыквенного » оранжевого » янтарного » жёлтого » ярко-зелёного » зелёного » цвета мирт » C-конец цвета папоротника
Цепь B: N-конец аквамаринового цвета » β-тяжи цианового цвета » лазурного » тенаровой сини » синего » ультрамаринового » спираль цвета индиго » β-тяжи фиолетового цвета » маджента » коралого цвета » цвета орхидеи » C-конец сиреневого
Анализ структуры спиралей и бета-листов в цепи B белка с кодом PDB 1XTM
В белке 1XTM цепь В содержит как спираль, так и β-лист, поэтому для анализа вторичной структуры белка я выбрал именно её.
На рис.2 хорошо видно положение спирали и β-листа в белке (спираль выделена фиолетовым цветом, а β-лист выделен жёлтым цветом)
Анализ спирали
В белке 1XTM спираль начинается с 98-ого остатка цепи В и заканчивается на 102-ом.
Структурные свойства:
- Спираль состоит из 5 аминокислотных остатков (1,67 витка);
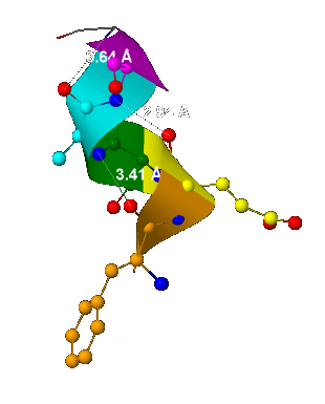
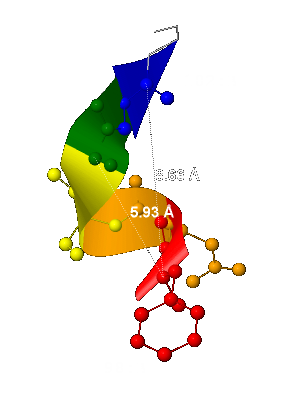
- Шаг спирали - 5,93 Å
(вычислено как расстояние между двумя ближайшими и лежащими друг над другом α-атомами углерода - рис.3); - Число остатков спирали на 1 виток - 3
(Видно из рис.3 - 3 остатка аминокислот, красный, оранжевый и жёлтый, формируют 1 виток спирали); - Остаток с номером n образует водородные связи с остатком n+3
(Некоторые водородные связи показаны пунктиром на рис.4)
| Параметр | α-спираль | 310-спираль | π-спираль | Спираль в 1XTM |
| Остатков на 1 виток | 3,6 | 3,0 | 4,4 | 3 |
| Шаг спирали | 5,4 Å | 6,0 Å | 4,8 Å | 5,93 Å |
В табл.1 представлены структурные свойства 3-ёх основных форм спиралей белков [1] и данные о спирали белка 1XTM. Сравнивая их, можно прийти к выводу, что спираль в 1XTM является 310-спиралью.
Анализ β-листа
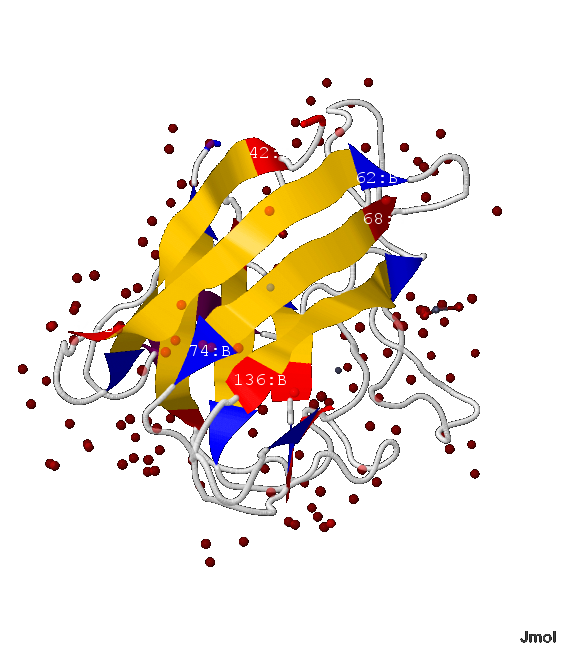
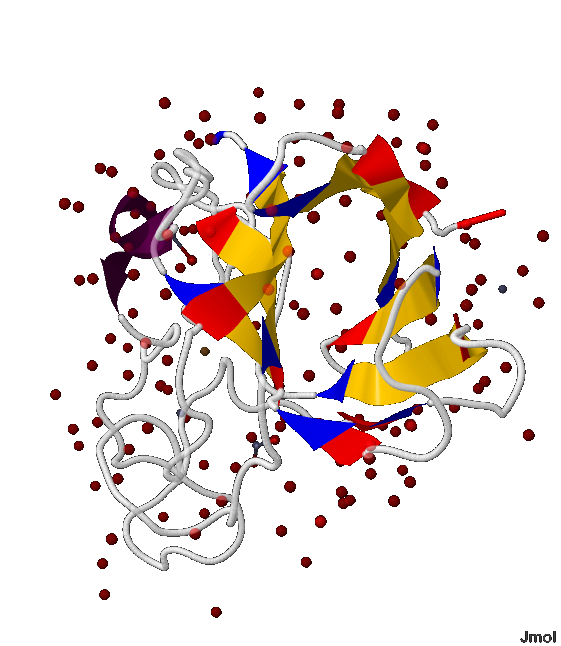
В белке 1XTM содержится β-лист из 9 β-тяжей: 42-49:B, 54-62:B, 68-74:B, 82-83:B, 85-88:B, 128-129:B, 136-142:B, 161-166:B, 183-189:B аминокислотные остатки.
- В этом β-листе есть 2 параллельных β-тяжа - 82-83:B и последующий 85-88:B; а остальные все антипараллельны, т.е. напротив N-начала каждого β-тяжа расположен C-конец последующего и предыдущего (показано на рис.5-7)
- Данный β-лист образует почти замнкнутую объёмную фигуру, напоминающую бочонок (показано на рис.5-8)
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры 1XTM
Так как в предыдущем разделе рассматривалась цепь B белка 1XTM, то при анализе взаимодейсвия боковых групп белка я решил изучить цепь A.
- В белке 1XTM содержится 2 цистеиновых остатка (93 и 186), связанных дисульфидным мостиком (показано на рис.9)
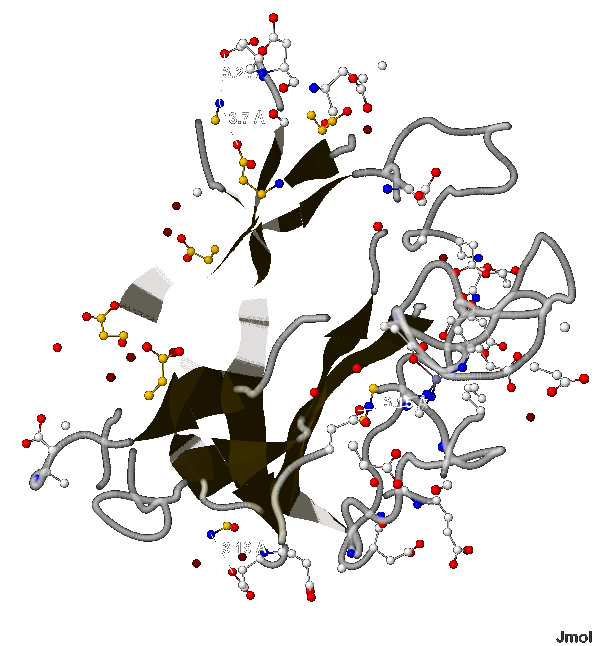
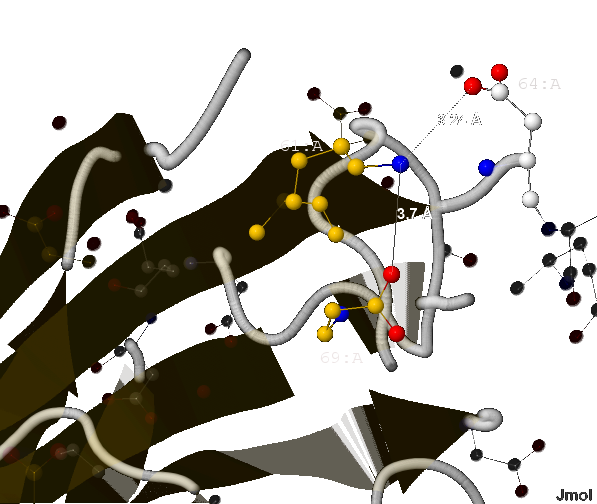
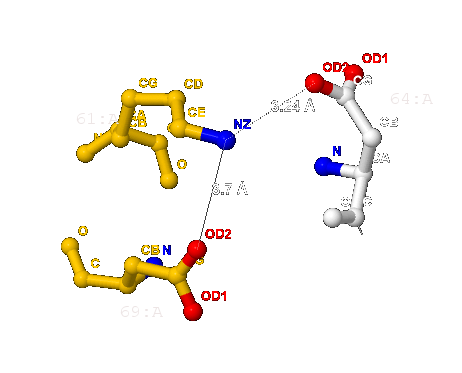
- Согласно [2] длина соляного мостика не может быть больше 4 Å. В А-цепи белка 1XTM мною найдено 4 таких связи (изображены на рис.10) длиной:
- 3.19 Å (между 49-ым и 51-ым аминокислотными остатками аспарагина и глутамата соответственно),
- 3.15 Å (между 112-ым и 170-ым - гистидина и аспартата),
- 3.7 Å (между 61-ым и 69-ым - лизина и аспартата) и
- 3.24 Å (между 61-ым и 64-ым - лизина и тоже аспартата);